Dimethylfumarat, BG12 (Tecfidera®)
Fumarat ist zugelassen für Erwachsene mit schubförmiger MS. Es wird als Tablette von 120 oder 240 mg 2 x täglich eingenommen. Bei einem Teil
der Patienten reduziert Fumarat die Schubrate und hält die Zunahme der Beeinträchtigung auf. An wichtigen Nebenwirkungen treten auf: Flush (Gesichtsrötung), Magen-Darm-Beschwerden, Verminderung von weißen Blutzellen. Zur Überwachung muss alle 6 – 8 Wochen ein Blutbild gemacht werden. Das Medikament wird in der Apotheke unter dem Namen Tecfidera® vertrieben.
Wirkungen & Nebenwirkungen im grafischen Überblick
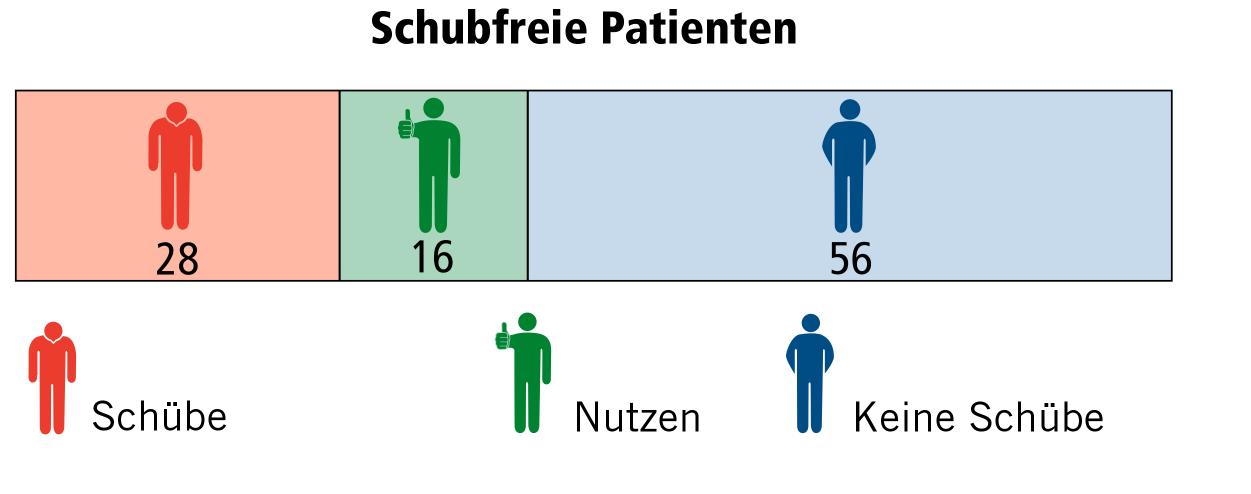
Schubfreie Patienten
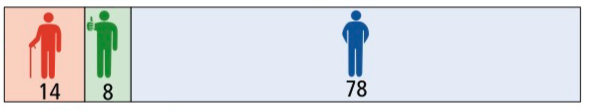
Patienten ohne Zunahme der Behinderung
Was ist Dimethylfumarat?
Dimethylfumarat ist abgeleitet von Fumarat oder auch Fumarsäure. Diese organisch-chemische Substanz kommt natürlicherweise im menschlichen Stoffwechsel vor und hat hier eine Schlüsselrolle in der Energiegewinnung. Zur besseren Verträglichkeit wurde es chemisch verändert zu Monomethyl- und Dimethylfumarat. Im Körper wird Dimethylfumarat schnell zu Monomethylfumarat abgebaut, was die eigentliche Wirksubstanz ist.
Im Folgenden wird der Einfachheit halber anstatt der vollständigen Bezeichnung „Dimethylfumarat“ die Kurzform „Fumarat“ verwendet.
Wie wirkt Dimethylfumarat?
Der genaue Wirkmechanismus von Fumarat bei Multipler Sklerose ist unklar. Bekannt ist aber, dass Fumarat Entzündungen hemmen kann: Das Immuntherapeutikum reduziert die Anzahl weißer Blutkörperchen (Leukozyten), vor allem der sogenannten T-Lymphozyten. Dies erfolgt vermutlich durch einen Mechanismus, der den Zelltod beschleunigt. Außerdem kann Fumarat die Aktivität aktivierter Immunzellen herabsetzen. Zudem drosselt es den oxidativen Stress von Zellen, weshalb ihm auch eine zellschützende Funktion zugeschrieben wird, zum Beispiel für Nervenzellen.
Für wen ist Dimethylfumarat zugelassen?
Fumarat ist seit 2014 von der Europäischen Zulassungsbehörde (EMA) zur Behandlung von erwachsenen Patienten mit schubförmig remittierender Multipler Sklerose zugelassen.
Eine Variante der Fumarsäure wird bereits seit über 20 Jahren zur Behandlung der Schuppenflechte (Psoriasis) eingesetzt.
Wie wird Dimethylfumarat eingenommen?
Fumarat wird als Kapsel von 240 mg (Erhaltungsdosis) zweimal täglich (morgens und abends) eingenommen. Zu Anfang empfiehlt es sich, das Medikament aufzudosieren, das heißt in den ersten sieben Tagen wird eine niedrigere Dosis von 120 mg (Startdosis) zweimal täglich eingenommen. Die Kapseln dürfen weder zerkleinert noch aufgelöst werden, sondern müssen als Ganzes mit einer ausreichenden Menge an Flüssigkeit heruntergeschluckt werden.
Die gleichzeitige Einnahme von Fumarat mit einer Mahlzeit (zum Frühstück bzw. Abendessen) kann die Verträglichkeit des Medikaments verbessern. Zudem wird empfohlen, bis ungefähr eine Stunde nach der Einnahme von Fumarat keine stark alkoholischen Getränke zu trinken.
Falls der möglicherweise auftretende Flush zu stark ist, kann die Dosis von 240 mg vorübergehend auf 120 mg reduziert werden. Auch eine zeitweise Einnahme von Aspirin kann den Flush mindern (siehe unten im Kapitel "Welche Nebenwirkungen hat Fumarat?").
Zudem kann die gleichzeitige Einnahme von Fumarat mit einer Mahlzeit die Verträglichkeit des Medikaments verbessern.
Hier sehen Sie ein Foto einer Medikamentenpackung und eines Blisters von Tecfidera®:
Bildquelle links: https://www.adlershop.ch/p/127080/tecfidera-kapseln-240mg-56-stueck
Bildquelle rechts: https://staublos.ch/2016/10/25/multiple-sklerose-ein-jahr-tecfidera-erfahrung/
Wie wirksam ist Dimethylfumarat bei schubförmiger MS?
Im Glossar finden Sie unter "Allgemeines zu Wirkungen und Nebenwirkungen von MS-Medikamenten" eine allgemeine Einführung in die Thematik, welche Ihnen helfen kann, die nachfolgenden Informationen zur Wirkung von Fumarat besser zu verstehen.
1.Wirkung auf die Schubfreiheit
Die Grafik am Kapitelanfang zeigt, wie viele Patienten nach zwei Jahren Therapie mit Fumarat bzw. Einnahme von Placebos noch schubfrei waren. Daraus kann man den absoluten Nutzen (absolute Risikoreduktion) und den relativen Nutzen (relative Risikoreduktion) berechnen.
Hier wird die Anzahl der Patienten mit Schüben beschrieben. Um Studienergebnisse mit unterschiedlichen Teilnehmerzahlen besser vergleichen zu können, werden die Ergebnisse bezogen auf 100 Patienten dargestellt:
Der tatsächliche Therapieeffekt zeigt sich, wenn man die Anzahl von Patienten mit Schüben unter Fumarat (28) von denen mit Schüben unter Placebo (44) abzieht. Hier profitieren 44 – 28, also 16 von 100 Patienten von der Therapie.
- 16 von 100 Patienten haben einen Nutzen von der Therapie.
- 28 von 100 Patienten profitieren nicht von der Therapie, da sie trotz der Einnahme von Fumarat einen Schub hatten.
- 56 von 100 Patienten profitieren nicht, da sie auch ohne Fumarat schubfrei geblieben sind.
2. Wirkung auf die Anzahl der Schübe pro Jahr
Die jährliche Schubrate zeigt, wie viele Schübe durchschnittlich pro Jahr pro Patient auftraten. Sie lag in der Placebo-Gruppe bei 0,37 Schüben gegenüber 0,19 in der Fumarat-Gruppe. Etwas verständlicher ausgedrückt: Die Patienten in der Placebo-Gruppe haben im Durchschnitt alle drei Jahre einen Schub, die Patienten in der Fumarat-Gruppe nur alle fünf Jahre.
3. Wirkung auf die Zunahme der Behinderung
Die Zunahme der Behinderung in zwei Jahren wurde in den oben beschriebenen Zulassungsstudien mithilfe des EDSS gemessen. Die Grafik am Kapitelanfang zeigt, wie viele Patienten nach einer zweijährigen Therapie mit Fumarat bzw. zweijähriger Einnahme von Placebos keine Zunahme der Behinderung hatten. Dargestellt sind wieder der absolute Nutzen (absolute Risikoreduktion) und der relative Nutzen.
Im Glossar finden Sie Angaben zum Nutzen von Medikamenten bei anderen Erkrankungen. So bekommen Sie einen Eindruck davon, wie groß die Therapieeffekte bei MS im Vergleich zu denen bei anderen Krankheiten sind.
Im Folgenden wird die Entwicklung der Behinderung in zwei Jahren beschrieben, jeweils bezogen auf 100 Patienten:
- 15 von 100 Patienten haben trotz der Fumarat-Therapie eine Zunahme der Behinderung
- 78 von 100 Patienten profitieren nicht von der Therapie, sie haben unabhängig von der Therapie keine Zunahme der Behinderung
- 7 von 100 Patienten haben durch die Einnahme von Fumarat keine Zunahme der Behinderung
Der tatsächliche Therapieeffekt zeigt sich, wenn man die Anzahl von Patienten mit einer Behinderungszunahme unter Fumarat (15) von denen mit Placebo (22) abzieht. Hier profitieren 22 - 15, also 7 von 100 Patienten von der Therapie.
4. Wirkung auf die MRT/das Kernspin in zwei Jahren
In der MRT treten Kontrastmittelanreicherungen und sogenannte T2-Herde auf, die als Ausdruck der Entzündung bei MS betrachtet werden. Dabei können Herde im Erkrankungsverlauf größer werden oder ganz neu auftreten.
Mit Placebo hatten die Patienten durchschnittlich zwei neue kontrastmittelanreichernde Herde, mit Fumarat waren es 0,3. Unter Placebo fanden sich 17 neue oder vergrößerte T2-Herde und vier unter Fumarat. Neue T1-Läsionen traten unter Placebo mit sechs und unter Fumarat mit zwei je Patient auf.
Da Kontrastmittelanreicherungen nur eine Momentaufnahme sind, stellen wir nur die Entwicklung der T2-Herde im Querschnitt eines Gehirns grafisch dar. Dargestellt ist die Anzahl von 100 Patienten ohne bzw. mit neuen oder vergrößerten Herden. 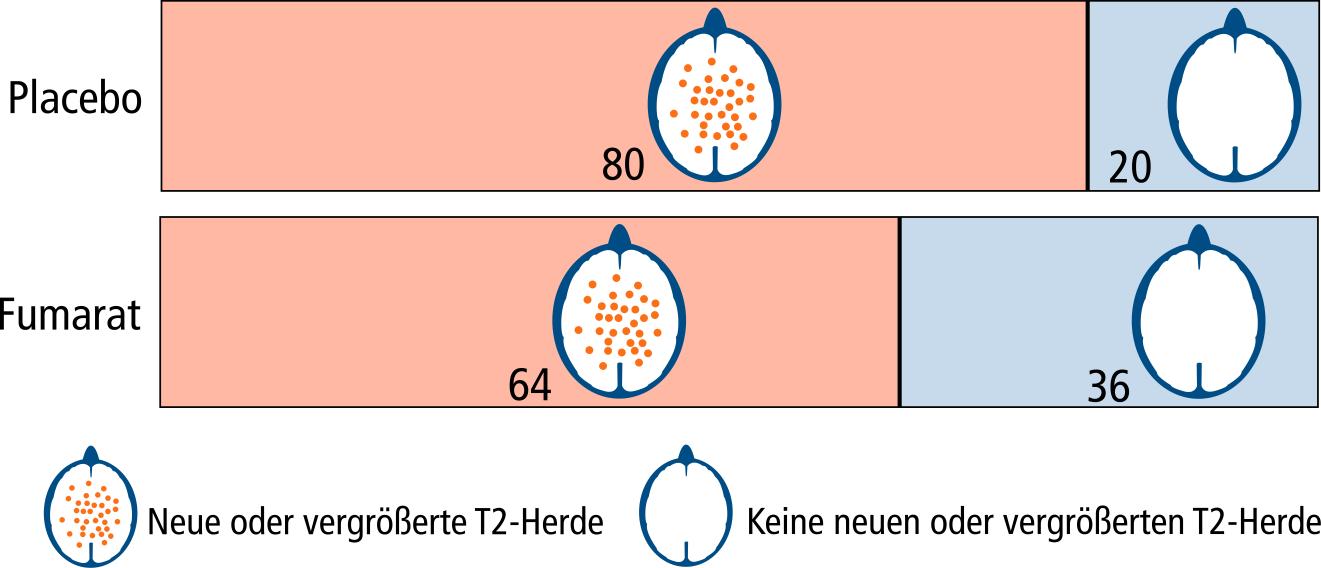
20% der Patienten in der Placebo-Gruppe und 36% in der Fumarat-Gruppe waren über die Studiendauer frei von neuen oder vergrößerten T2-Herden.
Im Glossar finden Sie Daten zu dem Anteil der Patienten, bei denen es über 2 Jahre keine Anzeichen einer Krankheitsaktivität gab (NEDA - no evidence of disease activity).
Zulassungsstudien
Um zu untersuchen, ob Fumarat zur Therapie der Multiplen Sklerose zugelassen werden konnte, wurden zwei große Studien durchgeführt: „DEFINE“[49] und „CONFIRM“[45].
1. DEFINE: Determination of the Efficacy and safety of oral Fumarate IN relapsing rEmitting MS study (Zulassungsstudie mit Placebo als Vergleich)
1.237 Patienten mit schubförmiger MS wurden entweder
- mit 2 x 240 mg (480 mg) Fumarat oder
- mit 3 x 240 mg (720 mg) Fumarat oder
- mit einem Placebo
zwei Jahre lang behandelt.
2. CONFIRM: COmparator and aN oral Fumarate In Relapsing–remitting Multiple Sclerosis (Zulassungsstudie mit Placebo und Copaxone als Vergleich)
1.086 Patienten mit schubförmiger MS wurden entweder
- mit 2 x 240 mg (480 mg) Fumarat oder
- mit 3 x 240 mg (720 mg) Fumarat oder
- mit 1 x 20 mg Copaxone oder
- mit einem Placebo
zwei Jahre lang behandelt.
Welche Nebenwirkungen hat Dimethylfumarat?
Bei wie vielen Patienten traten Nebenwirkungen auf?
Laut der Metaanalyse (Verlinkung) hatten 512 (67%) der Patienten in der Fumarat- Gruppe Nebenwirkungen und 376 (49%) der Patienten in der Placebo- Gruppe. Dieser Unterschied war statistisch signifikant.
Grundsätzlich ist wichtig zu wissen, dass Nebenwirkungen in Studien nicht nur bei den Patienten auftreten, die ein neues Medikament erhalten, sondern auch in der Studiengruppe mit einem bekannten Medikament oder Placebo (siehe "Allgemeines zu Wirkungen und Nebenwirkungen von MS-Medikamenten").
Bei wie vielen Patienten führten die Nebenwirkungen zum Therapieabbruch?
Bei 45 (6%) Patienten in der Placebo-Gruppe und bei 98 (13%) in der Fumarat-Gruppe führten die Nebenwirkungen zum Abbruch der Behandlung. Auch dieser Unterschied war signifikant.
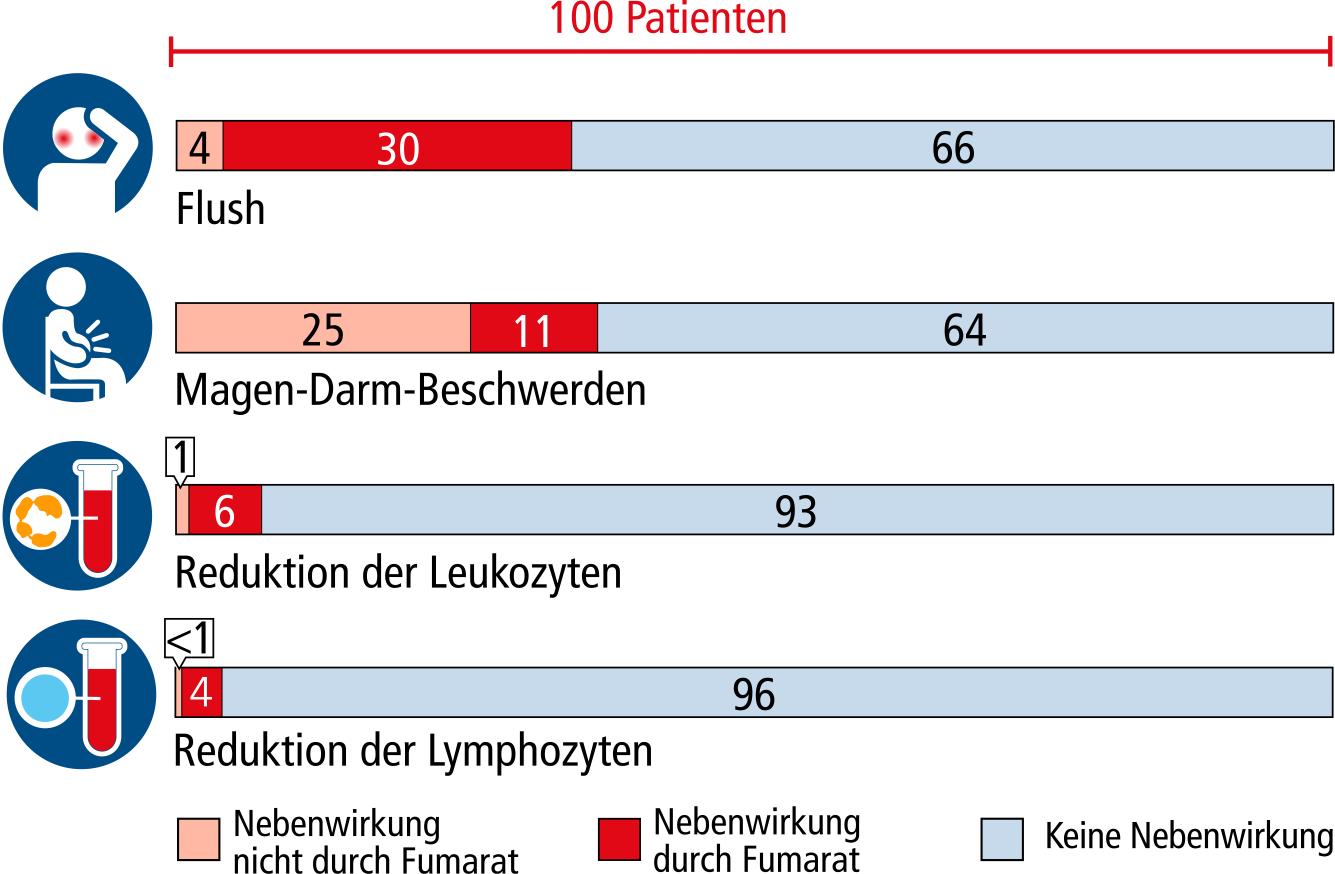
Häufige Nebenwirkungen
In der Tabelle sind Nebenwirkungen aufgeführt, die aus beiden Studien (DEFINE[49] und CONFIRM[45]) berichtet wurden und bei mindestens 2% der Patienten auftraten. Angegeben ist die Patientenzahl von 100 Patienten. 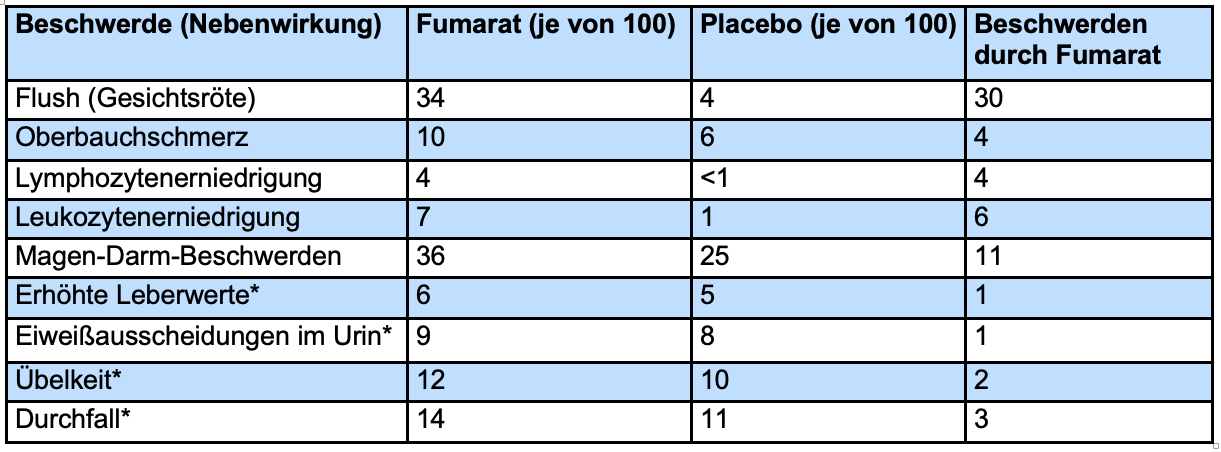
*Bei diesen Nebenwirkungen war der Unterschied zwischen der Fumarat- und der Placebo-Gruppe nicht statistisch signifikant.
Gesichtsrötung (Flush)
Eine Gesichtsrötung trat am häufigsten (circa 30% der Patienten) innerhalb der ersten 4 Wochen auf. Nach einem Monat war sie noch bei 5%, nach einem Jahr bei 3% der Patienten nachweisbar. Die Einnahme von Aspirin® (200 – 400 mg) 30 Minuten vor der Einnahme von Fumarat kann den Flush mindern. Allerdings sollte Aspirin nach spätestens 4 Wochen wieder abgesetzt werden, woraufhin der Flush zurückkehren kann.
Zudem trat bei 5% der Patienten in der Fumarat-Gruppe sowie bei 2% der Patienten in der Placebo-Gruppe ein Juckreiz auf. Dieser Unterschied von 3% war statistisch signifikant.
Magen-Darm-Beschwerden
Zu den Magen-Darm-Beschwerden zählen Oberbauchschmerzen (4%), Übelkeit (3%) und Erbrechen (2%). Diese waren zu Beginn häufiger und klangen meist nach vier bis sechs Wochen ab. Nach 4 Wochen berichteten noch 6% der Patienten, die Fumarat einnahmen, über Magen-Darm-Beschwerden, aber auch 4% derjenigen, die ein Placebo bekamen. Nach einem Jahr waren es nur noch 2%. Treten unter der Behandlung Durchfälle und Erbrechen auf, ist die Wirkung der Antibabypille unsicher.
Veränderungen von Blut- und anderen Laborwerten
Im ersten Jahr kam es bei 28% der Patienten zu einem Absinken der weißen Blutkörperchen (Leukozyten) im Vergleich zu 10% unter Placebo. Eine deutliche Verminderung (unter 3.000 Zellen/μl) der Zahl der weißen Blutkörperchen trat bei 6 von 100 Patienten unter der Einnahme von Fumarat auf. Insbesondere eine Untergruppe, die Lymphozyten, war dabei betroffen; bei 4 von 100 Patienten sank die Zahl auf unter 500/μl. Bei 4% der Patienten mit Fumarat-Therapie gegenüber weniger als 1% der Patienten unter Placebo fanden sich Werte <3000/Mikroliter bei den Leukozyten und <500/Mikroliter bei den Lymphozyten. Diese Veränderungen waren nicht bedeutsam und führten bei keinem der Patienten zu einer Änderung der Therapie.
Unter Fumarat traten Eiweißausscheidungen im Urin etwas häufiger als unter Placebo auf, die jedoch nie zur Therapieänderung führten. Ähnliches gilt für Leberwerthöhungen.
Infektionen
In DEFINE traten Infektionen bei 65% unter Placebo gegenüber 64% bzw. 68% unter Fumarat auf, meist als Atemwegs- oder Blasenentzündungen. Schwere Infekte traten bei je 2% in allen Gruppen auf. Somit traten bei der Therapie mit Fumarat Infekte nicht gehäuft auf. Dennoch ist zu beachten, dass alle Medikamente, die das Immunsystem beeinflussen, das Infektionsrisiko erhöhen können. Auch dies kann nur in Langzeitstudien geklärt werden.
Schwere Nebenwirkungen und Todesfälle
Durch Fumarat bedingte schwere Nebenwirkungen und Todesfälle traten in den Studien nicht gehäuft auf. In einer Fumarat-Gruppe kam es zu einem Schub mit tödlichen Komplikationen und in einer Placebo-Gruppe trat ein tödlicher Schlaganfall auf. Zwei weitere Todesfälle bei Patienten, die mit Fumarat behandelt wurden, waren durch Unfälle bedingt.
Magen-Darm-Entzündungen traten als schwere Nebenwirkung in allen Gruppen auf.
Krebserkrankungen
In CONFIRM[45] trat in der Placebo-Gruppe ein Brustkrebs auf, in der Glatirameracetat-Gruppe vier unterschiedliche Tumore und keine Tumore unter Fumarat. In DEFINE[49] traten in allen drei Gruppen je zwei Tumore auf. Neben zwei Tumoren in der Placebo-Gruppe waren dies unter Fumarat ein Brustkrebs, ein Gebärmutterhalstumor, ein Hautkrebs und ein Harnwegstumor. Dieser Unterschied war statistisch nicht signifikant, d. h. Krebserkrankungen traten bei Fumarat-Einnahme nicht gehäuft auf. Dennoch ist zu beachten, dass alle Medikamente, die das Immunsystem beeinflussen, das Krebsrisiko erhöhen können. Dies kann aber nur in Langzeitstudien geklärt werden.
Welche neuen Nebenwirkungen wurden nach Abschluss der Zulassungsstudien berichtet?
Bei der Behandlung mit einem verwandten Wirkstoff (Fumaderm®), der zur Therapie der Schuppenflechte (Psoriasis) eingesetzt wird, erkrankten bislang neun Patienten an einer Viruserkrankung des Gehirns, der progressiven multifokalen Leukenzephalopathie (PML). Sie tritt nur bei Menschen mit geschwächter Abwehr auf und kann zu schweren Behinderungen führen oder sogar tödlich sein. Bei der Behandlung von MS-Patienten mit Fumarat waren dies bis zum Juni 2017 fünf von über 271.000 weltweit behandelten Patienten. Möglicherweise steht das Risiko einer PML bei Fumarat im Zusammenhang mit einer deutlich reduzierten Lymphozytenzahl. Nach Übereinkunft von MS-Spezialisten und Behörden wurde der untere Grenzwert für Lymphozyten auf 500 pro Mikroliter (μl) festgelegt. Dieser Wert sollte nicht dauerhaft unterschritten werden. Zwischen 500 und 800/μl wird eine stärkere Überwachung empfohlen. Es ist dabei aber zu bedenken, dass die im Blut gemessene Anzahl der Lymphozyten nur einen groben Anhalt darüber geben kann, ob die Abwehrfunktionen des Immunsystems, beispielsweise gegen das PML-Virus, intakt sind.
Worauf muss bei der Therapie mit Dimethylfumarat geachtet werden?
Unter welchen Umständen sollte Fumarat nicht eingenommen werden?
Fumarat sollte nicht eingenommen werden
- von Kindern unter 18 Jahren,
- während der Schwangerschaft und Stillzeit,
- bei einer Allergie gegen Fumarat,
- bei Magen-Darm-Erkrankungen, Leber- oder Nieren-Erkrankungen
- und chronischen Infektionen wie Hepatitis oder AIDS.
Welche Sicherheitsabstände müssen eingehalten werden?
Bei Patienten, die bereits eine Therapie erhalten haben, die das Immunsystem beeinflusst oder hemmt, müssen vor einer Umstellung auf Dimethylfumarat bestimmte Sicherheitsabstände eingehalten werden. Diese richten sich nach der Wirkdauer der Medikamente. Die Wartezeit beträgt nach der Behandlung mit...
- Fingolimod und Teriflunomid (nach Auswaschung!) mindestens vier Wochen.
- Natalizumab und Daclizumab mindestens sechs bis acht Wochen.
- Azathioprin, Ciclosporin A, Cyclophosphamid, Methotrexat und Mitoxantron mindestens drei Monate.
- Cladribin mindestens 6 Monate.
- Alemtuzumab, Ocrelizumab und Rituximab mindestens 6 – 12 Monate.
Bei der vorherigen Einnahme von Interferonen oder Glatirameracetat müssen keine Sicherheitsabstände eingehalten werden, sofern sich eventuelle Blutbildveränderungen normalisiert haben.
Eine Kurzzeitbehandlung mit Kortikosteroiden (Kortison), zum Beispiel zur Schubtherapie, ist auch während der Behandlung mit Fumarat möglich.
Was muss während der Therapie kontrolliert werden?
Das MS-Kompetenznetz empfiehlt:
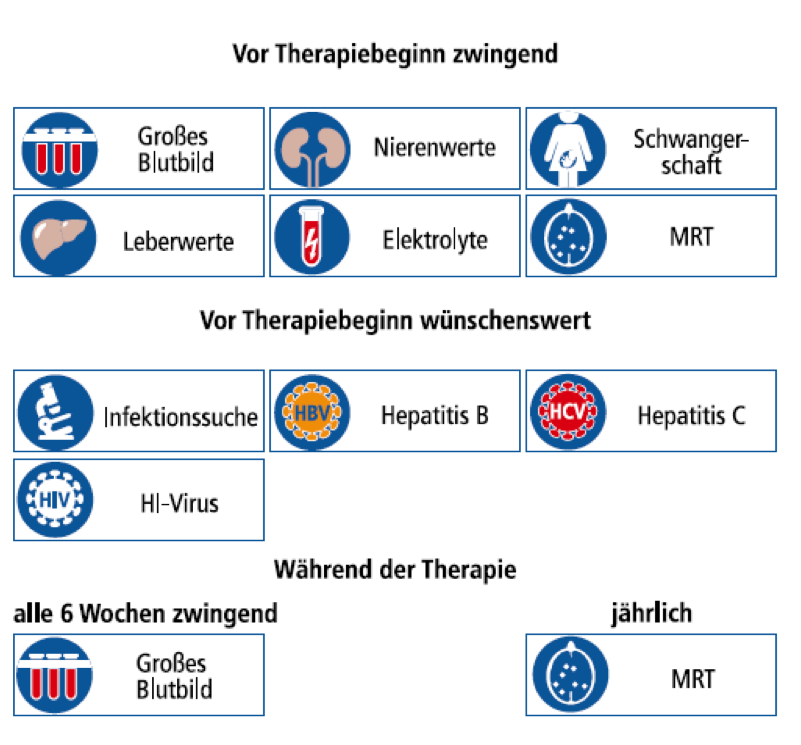
- vor Therapiebeginn: Differentialblutbild, Leber- und Nierenfunktionswerte, Elektrolyte, Ausschluss einer akuten Entzündung sowie Hepatitis B, C und Aids, Schwangerschaftstest
- unter der Therapie: alle 6-8 Wochen: Blutbild
- bei Werten der Leukozyten unter 3000/ul und Lymphozyten unter 500/ul sollte das Medikament ausgesetzt werden
- Die zunächst sechswöchigen Blutbildkontrollen können bei unauffälligem Verlauf im ersten Therapiejahr dann im 2. Jahr alle 3-6 Monate erfolgen. Wird jedoch ein Abfall der Lymphozytenzahl beobachtet, muss wieder häufiger kontrolliert werden.
Diese Empfehlungen sind als Vorsichtsmaßnahme zu werten. Gegenwärtig gibt es keinen Anhalt, dass vorübergehende Erniedrigungen der Anzahl an Leukozyten und Lymphozyten ein Risiko darstellen.
Dimethylfumarat - Häufig gestellte Fragen
Wirkt Fumarat besser oder schlechter als andere MS-Medikamente?
Vergleich mit Copaxone:
Systematische Vergleichsstudien mit anderen MS-Medikamenten wurden bislang nicht durchgeführt. Ein begrenzter Vergleich fand nur in der CONFIRM-Studie mit Glatirameracetat (Copaxone®) statt. Unter Glatiramerazetat waren 68 von 100 schubfrei gegenüber 71 bzw. 76 von 100 unter Fumarat. 84 von 100 waren ohne Zunahme der Beeinträchtigung gegenüber 87 von 100 unter Fumarat. Die Unterschiede waren statistisch nicht signifikant. Zusammenfassend finden sich damit keine klaren Hinweise für eine größere Wirksamkeit von Fumarat im Vergleich zu Glatirameracetat.
Vergleich mit beta-Interferonen, Gilenya®, Aubagio®, Tysabri®:
Hierzu liegen keine Daten vor.
Wie lange wird behandelt?
Genau wie andere immunmodulierende MS-Therapien wird Fumarat als Dauertherapie eingesetzt. Nutzen und Risiko der Einnahme müssen laufend überprüft werden. Ein Abschätzen des Nutzens ist oft frühestens nach einem Jahr möglich. Als Hinweise für eine Wirksamkeit werden allgemeine Schubfreiheit und das Fehlen neuer Herde im Kernspin angesehen. Deshalb empfiehlt das MS-Kompetenznetz eine Ausgangs-MRT nach vollem Wirkeintritt von Fumarat (ca. drei Monate) und anschließend jährlich eine MRT, um Nutzen und auch mögliche Risiken abzuschätzen.
Schwangerschaft und Stillzeit
Fumarat sollte in Schwangerschaft und Stillzeit nicht eingenommen werden. Dies ist als Vorsichtsmaßnahme zu werten, eine schädigende Wirkung auf den Embryo ist bislang nicht bekannt. Deshalb muss bei Eintreten einer Schwangerschaft unter Fumarat kein Abbruch der Schwangerschaft erfolgen. Allerdings sollte die Medikation abgesetzt werden und nur in Ausnahmefällen in der Schwangerschaft eingesetzt werden. Bis 2015 sind unter Fumarat-Einnahme 63 Schwangerschaften aus Studien und 135 Schwangerschaften nach Zulassung berichtet worden. Bei keiner kam es zu Komplikationen, die durch Fumarat verursacht wurden.
Möglicherweise geht Fumarat in die Muttermilch über und sollte in der Stillzeit deshalb nicht eingenommen werden.
Impfungen
Bisher sind keine negativen Effekte auf Impferfolge bekannt. Einige wenige Daten sprechen dafür, dass Standardimpfungen unter Fumarat wirksam bleiben. Sogenannte Lebendimpfstoffe, bei denen lebendige, aber unschädlich gemachte Erreger verwendet werden, müssen möglichst vermieden werden. Fumarat-Patienten haben möglicherweise keine ausreichende Abwehr und könnten durch die eigentlich harmlosen Impferreger krank werden.
Infektionen
Grundsätzlich muss Fumarat beim Auftreten üblicher Infekte nicht abgesetzt werden. Bei schweren Infekten oder gehäuften Infekten muss im Einzelfall jedoch ein Absetzen erwogen werden.
Dimethylfumarat - Alles auf einen Blick


