Bei wie vielen Patienten traten Nebenwirkungen auf?
Laut der Metaanalyse (Verlinkung) hatten 512 (67%) der Patienten in der Fumarat- Gruppe Nebenwirkungen und 376 (49%) der Patienten in der Placebo- Gruppe. Dieser Unterschied war statistisch signifikant.
Grundsätzlich ist wichtig zu wissen, dass Nebenwirkungen in Studien nicht nur bei den Patienten auftreten, die ein neues Medikament erhalten, sondern auch in der Studiengruppe mit einem bekannten Medikament oder Placebo (siehe "Allgemeines zu Wirkungen und Nebenwirkungen von MS-Medikamenten").
Bei wie vielen Patienten führten die Nebenwirkungen zum Therapieabbruch?
Bei 45 (6%) Patienten in der Placebo-Gruppe und bei 98 (13%) in der Fumarat-Gruppe führten die Nebenwirkungen zum Abbruch der Behandlung. Auch dieser Unterschied war signifikant.
Häufige Nebenwirkungen
In der Tabelle sind Nebenwirkungen aufgeführt, die aus beiden Studien (DEFINE[49] und CONFIRM[45]) berichtet wurden und bei mindestens 2% der Patienten auftraten. Angegeben ist die Patientenzahl von 100 Patienten. 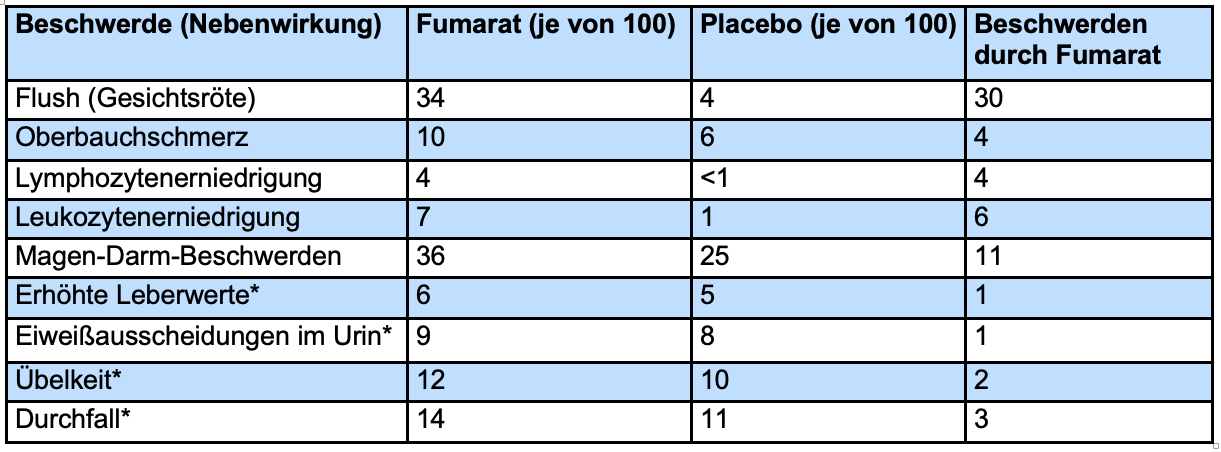
*Bei diesen Nebenwirkungen war der Unterschied zwischen der Fumarat- und der Placebo-Gruppe nicht statistisch signifikant.
Gesichtsrötung (Flush)
Eine Gesichtsrötung trat am häufigsten (circa 30% der Patienten) innerhalb der ersten 4 Wochen auf. Nach einem Monat war sie noch bei 5%, nach einem Jahr bei 3% der Patienten nachweisbar. Die Einnahme von Aspirin® (200 – 400 mg) 30 Minuten vor der Einnahme von Fumarat kann den Flush mindern. Allerdings sollte Aspirin nach spätestens 4 Wochen wieder abgesetzt werden, woraufhin der Flush zurückkehren kann.
Zudem trat bei 5% der Patienten in der Fumarat-Gruppe sowie bei 2% der Patienten in der Placebo-Gruppe ein Juckreiz auf. Dieser Unterschied von 3% war statistisch signifikant.
Magen-Darm-Beschwerden
Zu den Magen-Darm-Beschwerden zählen Oberbauchschmerzen (4%), Übelkeit (3%) und Erbrechen (2%). Diese waren zu Beginn häufiger und klangen meist nach vier bis sechs Wochen ab. Nach 4 Wochen berichteten noch 6% der Patienten, die Fumarat einnahmen, über Magen-Darm-Beschwerden, aber auch 4% derjenigen, die ein Placebo bekamen. Nach einem Jahr waren es nur noch 2%. Treten unter der Behandlung Durchfälle und Erbrechen auf, ist die Wirkung der Antibabypille unsicher.
Veränderungen von Blut- und anderen Laborwerten
Im ersten Jahr kam es bei 28% der Patienten zu einem Absinken der weißen Blutkörperchen (Leukozyten) im Vergleich zu 10% unter Placebo. Eine deutliche Verminderung (unter 3.000 Zellen/μl) der Zahl der weißen Blutkörperchen trat bei 6 von 100 Patienten unter der Einnahme von Fumarat auf. Insbesondere eine Untergruppe, die Lymphozyten, war dabei betroffen; bei 4 von 100 Patienten sank die Zahl auf unter 500/μl. Bei 4% der Patienten mit Fumarat-Therapie gegenüber weniger als 1% der Patienten unter Placebo fanden sich Werte <3000/Mikroliter bei den Leukozyten und <500/Mikroliter bei den Lymphozyten. Diese Veränderungen waren nicht bedeutsam und führten bei keinem der Patienten zu einer Änderung der Therapie.
Unter Fumarat traten Eiweißausscheidungen im Urin etwas häufiger als unter Placebo auf, die jedoch nie zur Therapieänderung führten. Ähnliches gilt für Leberwerthöhungen.
Infektionen
In DEFINE traten Infektionen bei 65% unter Placebo gegenüber 64% bzw. 68% unter Fumarat auf, meist als Atemwegs- oder Blasenentzündungen. Schwere Infekte traten bei je 2% in allen Gruppen auf. Somit traten bei der Therapie mit Fumarat Infekte nicht gehäuft auf. Dennoch ist zu beachten, dass alle Medikamente, die das Immunsystem beeinflussen, das Infektionsrisiko erhöhen können. Auch dies kann nur in Langzeitstudien geklärt werden.
Schwere Nebenwirkungen und Todesfälle
Durch Fumarat bedingte schwere Nebenwirkungen und Todesfälle traten in den Studien nicht gehäuft auf. In einer Fumarat-Gruppe kam es zu einem Schub mit tödlichen Komplikationen und in einer Placebo-Gruppe trat ein tödlicher Schlaganfall auf. Zwei weitere Todesfälle bei Patienten, die mit Fumarat behandelt wurden, waren durch Unfälle bedingt.
Magen-Darm-Entzündungen traten als schwere Nebenwirkung in allen Gruppen auf.
Krebserkrankungen
In CONFIRM[45] trat in der Placebo-Gruppe ein Brustkrebs auf, in der Glatirameracetat-Gruppe vier unterschiedliche Tumore und keine Tumore unter Fumarat. In DEFINE[49] traten in allen drei Gruppen je zwei Tumore auf. Neben zwei Tumoren in der Placebo-Gruppe waren dies unter Fumarat ein Brustkrebs, ein Gebärmutterhalstumor, ein Hautkrebs und ein Harnwegstumor. Dieser Unterschied war statistisch nicht signifikant, d. h. Krebserkrankungen traten bei Fumarat-Einnahme nicht gehäuft auf. Dennoch ist zu beachten, dass alle Medikamente, die das Immunsystem beeinflussen, das Krebsrisiko erhöhen können. Dies kann aber nur in Langzeitstudien geklärt werden.
Welche neuen Nebenwirkungen wurden nach Abschluss der Zulassungsstudien berichtet?
Bei der Behandlung mit einem verwandten Wirkstoff (Fumaderm®), der zur Therapie der Schuppenflechte (Psoriasis) eingesetzt wird, erkrankten bislang neun Patienten an einer Viruserkrankung des Gehirns, der progressiven multifokalen Leukenzephalopathie (PML). Sie tritt nur bei Menschen mit geschwächter Abwehr auf und kann zu schweren Behinderungen führen oder sogar tödlich sein. Bei der Behandlung von MS-Patienten mit Fumarat waren dies bis zum Juni 2017 fünf von über 271.000 weltweit behandelten Patienten. Möglicherweise steht das Risiko einer PML bei Fumarat im Zusammenhang mit einer deutlich reduzierten Lymphozytenzahl. Nach Übereinkunft von MS-Spezialisten und Behörden wurde der untere Grenzwert für Lymphozyten auf 500 pro Mikroliter (μl) festgelegt. Dieser Wert sollte nicht dauerhaft unterschritten werden. Zwischen 500 und 800/μl wird eine stärkere Überwachung empfohlen. Es ist dabei aber zu bedenken, dass die im Blut gemessene Anzahl der Lymphozyten nur einen groben Anhalt darüber geben kann, ob die Abwehrfunktionen des Immunsystems, beispielsweise gegen das PML-Virus, intakt sind.
