Bei wie vielen Patienten traten Nebenwirkungen auf?
In den beiden Zulassungsstudien[91] hatten 83% der Patienten sowohl der Interferon-Gruppe als auch der Ocrelizumab-Gruppe Nebenwirkungen.
Grundsätzlich ist wichtig zu wissen, dass Nebenwirkungen in Studien nicht nur bei den Patienten auftreten, die ein neues Medikament erhalten, sondern auch in der Studiengruppe mit einem bekannten Medikament oder Placebo.
Bei wie vielen Patienten führten die Nebenwirkungen zum Therapieabbruch?
Bei 51 (6%) Patienten in der Interferon-Gruppe und bei 19 (3,5%) in der Ocrelizumab-Gruppe führten die Nebenwirkungen zum Abbruch der Behandlung.
Häufige Nebenwirkungen
In der Tabelle sind Nebenwirkungen aufgeführt, die aus den Zulassungsstudien OPERA-1 und OPERA-2 berichtet wurden und bei mindestens 2% der Patienten auftraten. Angegeben ist die Patientenzahl von 100 Patienten. In der Grafik zu Anfang des Kapitels sowie in der Faktenbox weiter unten werden jedoch lediglich die wichtigsten Nebenwirkungen dargestellt.
Die blau-weiße Tabelle zeigt die Beschwerden, die in der Ocrelizumab-Gruppe häufiger auftraten als in der Interferon-Gruppe. Darunter zeigt die grün-weiße Tabelle die Beschwerden, die in der Interferon-Gruppe häufiger auftraten als in der Ocrelizumab-Gruppe.
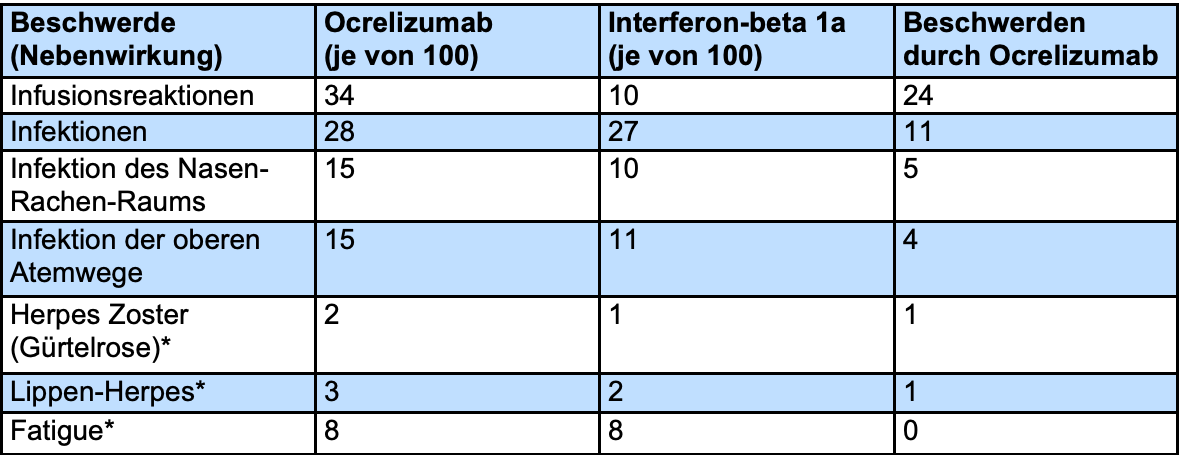
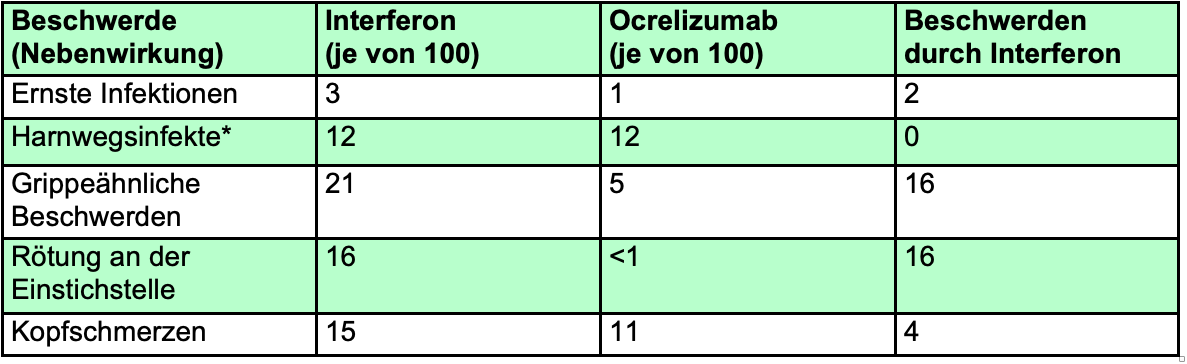
*Bei diesen Nebenwirkungen war der Unterschied zwischen der Ocrelizumab- und der Interferon-Gruppe nicht signifikant.
Wie Sie der grün-weißen Tabelle entnehmen können, traten einige Nebenwirkungen häufiger bei der Einnahme von Interferon-beta 1a auf. Dazu gehörten Kopfschmerzen (bei 4/100), grippeähnliche Symptome (bei 17/100) und Rötung der Einstichstelle (bei 15/100). Detaillierte Angaben zu Nebenwirkungen bei Einnahme von Interferon finden Sie im Kapitel "Interferone".
Laborwertveränderungen
Bei den Laborwerten sind nur Veränderungen bei den weißen Blutzellen (Lymphozyten) berichtet. Hier ist innerhalb von 2 Wochen nach Therapie eine bestimmte Untergruppe der B-Lymphozyten nicht mehr nachweisbar. Der Effekt hielt unter der Therapie bis zum Studienende an (siehe weiter oben im Kapitel „Wie wirkt Ocrelizumab?“).
Infusionsreaktionen
Infusionsreaktionen traten bei Ocrelizumab häufiger auf. Dies waren z.B. Juckreiz, Ausschlag, Hautreizung, Kopfschmerz, Müdigkeit, Schwindel, Luftnot, Übelkeit, Herzrasen. Es traten keine tödlichen Infusionsreaktionen auf, die Reaktionen waren überwiegend leicht bis moderat. Bei einem Patienten der Ocrelizumab-Gruppe kam es zu einem lebensbedrohlichen Verkrampfen der Bronchien (Bronchospasmus), der behandelt werden musste.
Am häufigsten traten Infusionsreaktionen bei der ersten Ocrelizumab-Gabe auf, bei weiteren Ocrelizumab-Gaben traten Infusionsreaktionen seltener auf und waren weniger schwer.
Infektionen
Insgesamt traten Infektionen etwas häufiger bei Einnahme von Ocrelizumab auf. Dies waren vor allem Erkältungen und andere Infektionen der oberen Atemwege.
Bei 6% Patienten der Ocrelizumab-Gruppe und bei 3% der Patienten der Interferon-Gruppe traten Infektionen durch Herpes-Viren auf (z.B. Herpes Zoster, „Gürtelrose“ oder Herpes Simplex, d.h. Herpes im Bereich des Mundes, „Lippenherpes“). Die Herpes-Infektionen verliefen in den meisten Fällen leicht oder moderat (mäßig schwer).
Folgende seltene Infektionen wurden darüber hinaus berichtet: Ein Patient mit Ocrelizumab musste aufgrund einer Herpes-Infektion im Genitalbereich im Krankenhaus behandelt werden. Schwere Infektionen unter Ocrelizumab waren: 3x Blinddarmentzündung, 2x Entzündungen des Hautfettgewebes, 2x Nierenbeckenentzündung, Sepsis (Blutvergiftung), 1x Herpes simplex, 1x Lungenentzündung (Pneumonie) und eine schwere obere Atemwegsentzündung.
Unter Interferon-beta 1a kam es zu 3 Blinddarmentzündungen, 2x Abszess, 2x Zellulitis an der Injektionsstelle, 2x Lungenentzündung, 2x Blasenentzündung und verschiedene andere Infekte in Einzelfällen.
Schwere Nebenwirkungen und Todesfälle
Schwere Nebenwirkungen, z.B. schwere Infektionen, lebensbedrohliche Infusionsreaktionen, kamen bei Einnahme von Ocrelizumab nicht gehäuft vor. In der Interferon-Gruppe kam es bei 9 von 100 Patienten zu schweren Nebenwirkungen, in der Ocrelizumab-Gruppe bei 7 von 100 Patienten. Dies waren unter Interferon-beta 1a bei 3 von 100 und unter Ocrelizumab bei 1 von 100 Fällen Infektionen.
Während der Studie traten 3 Todesfälle auf, 2 davon in der Interferon-Gruppe, 1 in der Ocrelizumab-Gruppe. Die Ursachen waren in der Interferon-Gruppe ein Darmverschluss und ein Suizid, in der Ocrelizumab-Gruppe ein Suizid.
Krebserkrankungen
Während der Studie traten bei 4 Patienten, die Ocrelizumab erhielten, bösartige Tumoren auf: 2x Brustkrebs, 1x Nierenkrebs, 1x Hautkrebs.
In der Interferon-Gruppe traten bei 2 Patienten bösartige Tumoren auf: 1x Lymphdrüsenkrebs und 1x Plattenepithelkrebs im Bereich der Brust.
Dieser Unterschied ist jedoch statistisch nicht signifikant. Das heißt, dass unter Ocrelizumab Krebserkrankungen nicht sicher gehäuft auftraten. Dennoch ist zu beachten, dass alle Medikamente, die das Immunsystem beeinflussen, das Krebsrisiko erhöhen können. Dies kann aber nur in Langzeitdatensammlungen geklärt werden.
Welche neuen Nebenwirkungen bei schubförmiger MS wurden nach Abschluss der Zulassungsstudien berichtet?
Bei sechs Patienten, die mit anderen Immuntherapien vorbehandelt wurden, wurde eine progressive multifokale Leukenzephalopathie (PML) festgestellt (Stand: September 2018). Diese Patienten hatten teilweise schubförmige, aber auch sekundär und primär progrediente MS-Verläufe. Die wissenschaftliche und behördliche Einschätzung ist hier, dass alle Patienten schon vor der Ocrelizumab-Gabe eine PML unter Natalizumab (5 Fälle) oder Fingolimod (1 Fall) entwickelt hatten, diese also nicht Ocrelizumab zugeschrieben werden kann.
