Grundsätzlich wird in der medizinischen Forschung die Primär- von der Sekundärforschung unterschieden. In der Primärforschung werden Studien durchgeführt und in der Sekundärforschung bereits vorhandene Ergebnisse aus Studien (systematisch) zusammengefasst. Die quantitative Primärforschung gliedert sich in weitere drei Hauptbereiche:
- medizinische Grundlagenforschung
- klinische Forschung und
- epidemiologische Forschung.
Die unten stehende Grafik gibt einen Überblick über verschiedene Forschungsdesigns, wobei eine genaue Zuordnung teilweise schwierig ist. Für die MS-Forschung und dieses Wiki wird hier auf besonders relevante Forschungsmethoden (z.B. RCT und Prognosestudien) genauer eingegangen.
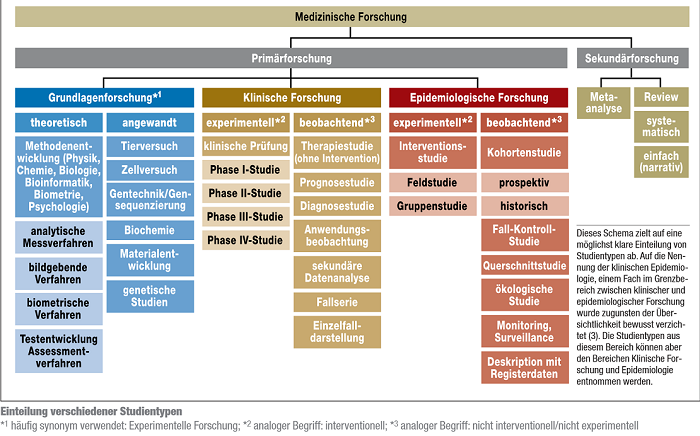
Abb.: Studiendesigns[1]
Zur Grundlagenforschung (auch experimentelle Forschung genannt) zählen zum Beispiel Zell- und Tierversuche, Studien zu Arzneimitteleigenschaften, physiologische und genetische Untersuchungen. Zudem stellen die Entwicklung und Verbesserung bildgebender (z.B. Magnetresonanztomografie) und analytischer Messverfahren (z.B. Bestimmung von Genen und Enzymen) sowie die Entwicklung von statistischen Testverfahren wichtige Bereiche der Grundlagenforschung dar.[1]
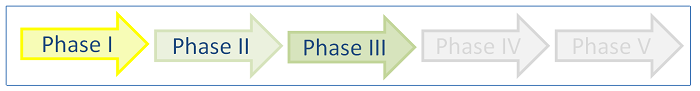
Die klinische Forschung gliedert sich in die Durchführung von experimentellen (interventionellen) und beobachtenden (nicht interventionellen) Studien. Bei einer klinischen (Arzneimittel-) Prüfung, handelt es sich um eine klinische experimentelle Studie bei der nach dem Arzneimittelgesetz § 4 eine Untersuchung am Menschen unternommen wird, um die Wirkung von Arzneimitteln nachzuweisen bzw. zu erforschen (auch Nebenwirkungen, Aufnahme und Verteilung im Stoffwechsel und Ausscheidung) und die Unbedenklichkeit oder Wirksamkeit der Arzneimittel nachgewiesen werden soll. Hierbei werden die Studien weiter in Phase I- bis Phase IV-Studien unterteilt. Auf die verschiedenen Phasen wird im Folgenden genauer eingegangen:
- Phase I: Humanpharmakologie
Erste Erprobung eines Arzneimittels an zumeist gesunden Menschen. Ziel ist es, durch eine ein- oder mehrmalige Gabe die Unbedenklichkeit eines Medikaments zu bewerten und Ergebnisse zu gewinnen, wie der Wirkstoff vom menschlichen Körper aufgenommen, verteilt, verstoffwechselt, abgebaut und ausgeschieden wird.

- Phase II: Therapeutische Erprobung
Zumeist wird mit einer kleinen Fallzahl an kranken Menschen die Wirksamkeit getestet und zugleich die richtige Dosis gesucht.

- Phase III: Therapeutische Bestätigung
In dieser Phase wird die Untersuchung mit einer festgelegten Dosierung sowie bestimmten Sicherheits- und Wirksamkeitsparametern mit einer relativ großen Patientengruppe durchgeführt. Es soll nachgewiesen werden, dass der Wirkstoff einen Einfluss auf krankhafte Ausgangswerte hat. Deshalb erhält eine Vergleichsgruppe einen Scheinwirkstoff (Placebo). In der Regel findet die Anwendung über einen längeren Zeitraum statt.
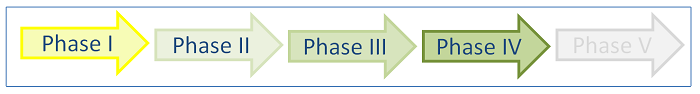
- Phase IV: Therapeutische Anwendung
Hierzu gehören alle Studien, die nach der Zulassung eines Wirkstoffes durchgeführt werden. Sie dienen unter anderem zur weiteren Abschätzung der Risiken und des Nutzens eines Medikaments. So können beispielsweise sehr seltene Nebenwirkungen eines Medikaments nur festgestellt werden, wenn sehr viele Menschen über einen längeren Zeitraum beobachtet werden (Vergleich mit einer Kontrollgruppe). Zudem sollen Erkenntnisse gewonnen werden, wie sich das Medikament im Alltag oder im Vergleich mit anderen Medikamenten bewährt (Starke und Geisslinger, 2005).
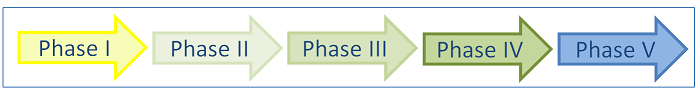
- Phase V: Nutzenbewertung
Als eine weitere fünfte Phase ließe sich die Nutzenbewertung eines Medikaments durch das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) bestimmen. "Im Rahmen seiner Aufgabe, den Gemeinsamen Bundesausschuss (G-BA) und den Spitzenverband der gesetzlichen Krankenversicherung (GKV-Spitzenverband) bei der Erfüllung ihres gesetzlichen Auftrags zu unterstützen, bewertet das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) Nutzen und Schaden von medizinischen Interventionen sowie deren wirtschaftliche Implikationen, um zu einer kontinuierlichen Verbesserung der Qualität und Effizienz der Gesundheitsversorgung der deutschen Bevölkerung beizutragen" (Zitat: IQWiG, 2009).[2]
Bei nicht interventionellen klinischen Studien handelt es sich um patientenbezogene Beobachtungsstudien, innerhalb derer Patienten eine individuell abgestimmte Therapie erhalten. Die Form der Therapie wird abhängig von Diagnose und Patientenwunsch mit dem behandelnden Arzt festgelegt. Prognosestudien, Anwendungsbeobachtungen und Einzelfallserien zählen beispielsweise zu den nicht interventionellen Studien.[1]
