Bei wie vielen Patienten traten Nebenwirkungen auf?
Laut der gepoolten Analyse aus den Zulassungsstudien im EPAR (siehe oben im Kapitel "Welche Zulassungsstudien wurden durchgeführt?") hatten in der Placebo-Gruppe 90% Patienten Nebenwirkungen und in der Teriflunomid-Gruppe 92%. Der Unterschied war nicht statistisch signifikant.
Grundsätzlich ist wichtig zu wissen, dass Nebenwirkungen in Studien nicht nur bei den Patienten auftreten, die ein neues Medikament erhalten, sondern auch in der Studiengruppe mit einem bekannten Medikament oder Placebo.
Bei wie vielen Patienten führten die Nebenwirkungen zum Therapieabbruch?
Bei 13% in der Placebo-Gruppe und 16% in der Teriflunomid-Gruppe führten die Nebenwirkungen zum Abbruch der Behandlung. Dieser Unterschied war statistisch signifikant.
Häufige Nebenwirkungen
In einer Studie von Comi et al. wurden die Nebenwirkungsdaten aus mehreren Studien, darunter auch die aus TEMSO und TOWER, (gepoolt) zusammengefasst. Allerdings dauerten die Einzelstudien unterschiedlich lange, was dazu führte, dass die Nebenwirkungsdaten nicht gut vergleichbar waren und die zusammenfassende Analyse nicht geeignet war. Daher wurden die Nebenwirkungsdaten von den Autoren selbst gepoolt. In der Tabelle sind Nebenwirkungen aufgeführt, die bei mindestens 2% der Patienten auftraten. 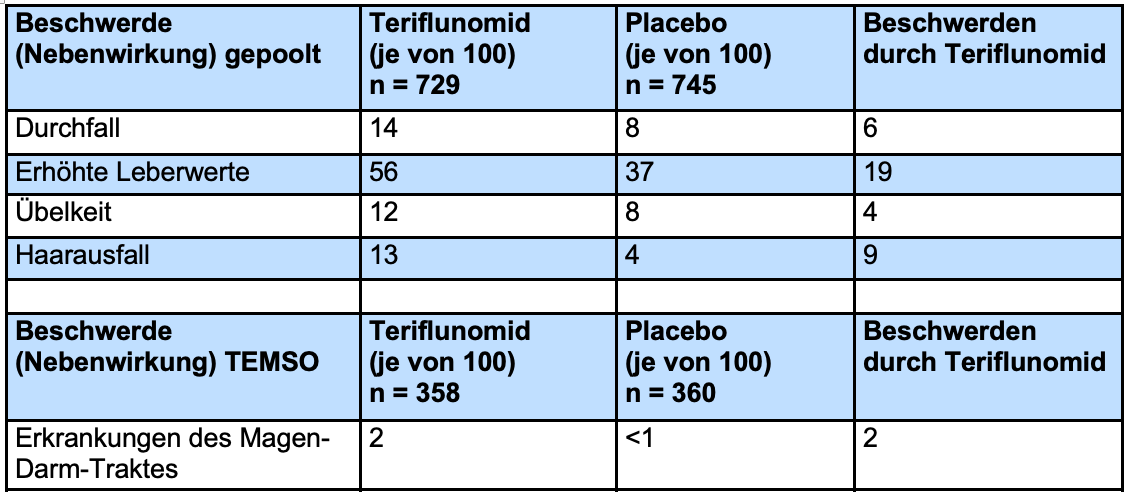
Eine verringerte Haardichte/ein Haarausfall trat am häufigsten innerhalb der ersten 6 Therapiemonate auf. In der Regel besserte sich die Haardichte im Verlauf der Therapie wieder.
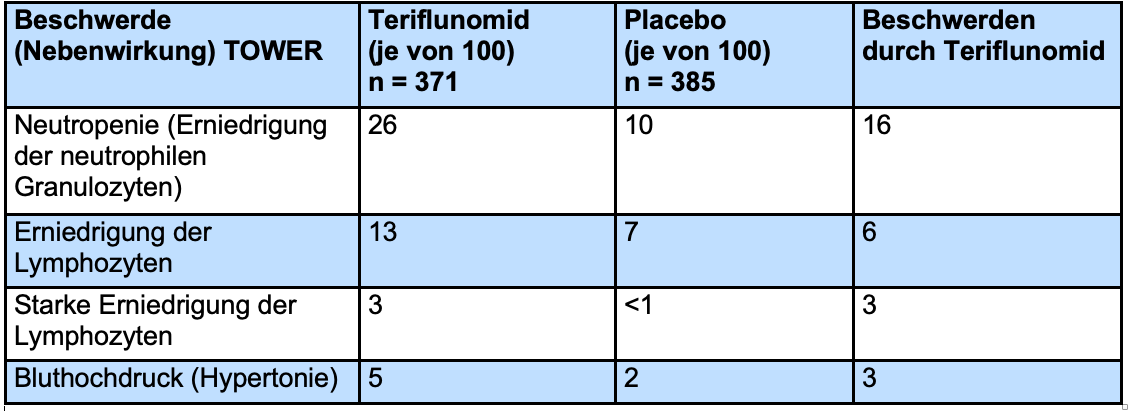
Darüber hinaus gab es einige Nebenwirkungen, die nur in einer der beiden Studien berichtet wurden. In der TOWER-Studie[53] traten signifikant häufiger Erniedrigungen der Leukozytenzahlen (Placebo-Gruppe 7%, Teriflunomid-Gruppe 17%) und Lymphozytenzahlen (Placebo-Gruppe 7%, Teriflunomid-Gruppe 16%) auf.
Zusätzlich zeigte sich eine Teriflunomid-bedingte Erhöhung des Blutdrucks bei 3 von 100 Patienten (5% Teriflunomid und 2% Placebo). In der TEMSO-Studie traten signifikant häufiger Erkrankungen des Magen-Darm-Trakts auf (Placebo-Gruppe <0,5% und Teriflunomid-Gruppe 2%).
Krebserkrankungen
In der Placebo-Gruppe lag die Krebsrate bei 1%. Es traten ein Brustkrebs, ein Schilddrüsenkrebs und ein Gebärmutterhalskrebs auf. Unter Teriflunomid wurde ein Fall eines Gebärmutterhalskrebses im Frühstadium dokumentiert. In der TOWER- Studie[53] trat in der Teriflunomid-Gruppe ein Schilddrüsenkrebs auf. Insgesamt traten Krebserkrankungen bei Teriflunomid-Einnahme also nicht gehäuft auf. Dennoch ist zu beachten, dass alle Medikamente, die das Immunsystem beeinflussen, das Krebsrisiko erhöhen können. Dies kann aber nur in Langzeitstudien geklärt werden.
Infektionen
Infekte traten bei der Therapie mit Teriflunomid nicht gehäuft auf. Dennoch ist zu beachten, dass alle Medikamente, die das Immunsystem beeinflussen, das Infektionsrisiko erhöhen können. Auch dies kann nur in Langzeitstudien geklärt werden.
Welche neuen Nebenwirkungen wurden nach Abschluss der Zulassungsstudien berichtet?
2017 kam es nach dreimonatiger Teriflunomid-Therapie und vorheriger Natalizumab-Therapie bei einem Patienten zum Verdacht auf eine Viruserkrankung des Gehirns, die progressive multifokale Leukenzephalopathie (PML). Die Diagnose wurde bisher nicht bestätigt. PML tritt nur bei Menschen mit geschwächter Abwehr auf und kann zu schweren Behinderungen führen oder sogar tödlich sein.
