Die folgenden Daten entstammen der oben beschriebenen Zulassungsstudie FREEDOMS[54].
Bei wie vielen Patienten traten Nebenwirkungen auf?
Laut der FREEDOMS-Studie hatten 401 von 425 (94%) der Patienten in der Fingolimod-Gruppe Nebenwirkungen und 387 von 418 (93%) der Patienten in der Placebo-Gruppe. Dieser Unterschied war statistisch nicht signifikant.
Grundsätzlich ist wichtig zu wissen, dass Nebenwirkungen in Studien nicht nur bei den Patienten auftreten, die ein neues Medikament erhalten, sondern auch in der Studiengruppe mit einem bekannten Medikament oder Placebo (siehe "Allgemeines zu Wirkungen und Nebenwirkungen von MS-Medikamenten").
Bei wie vielen Patienten führten die Nebenwirkungen zum Therapieabbruch?
In beiden Gruppen brachen je 8% der Patienten die Behandlung aufgrund von Nebenwirkungen ab.
Häufige Nebenwirkungen
In der Tabelle sind Nebenwirkungen aufgeführt, die aus der Zulassungsstudie FREEDOMS berichtet wurden und bei mindestens 2% der Patienten auftraten. Angegeben ist die Patientenzahl von 100 Patienten.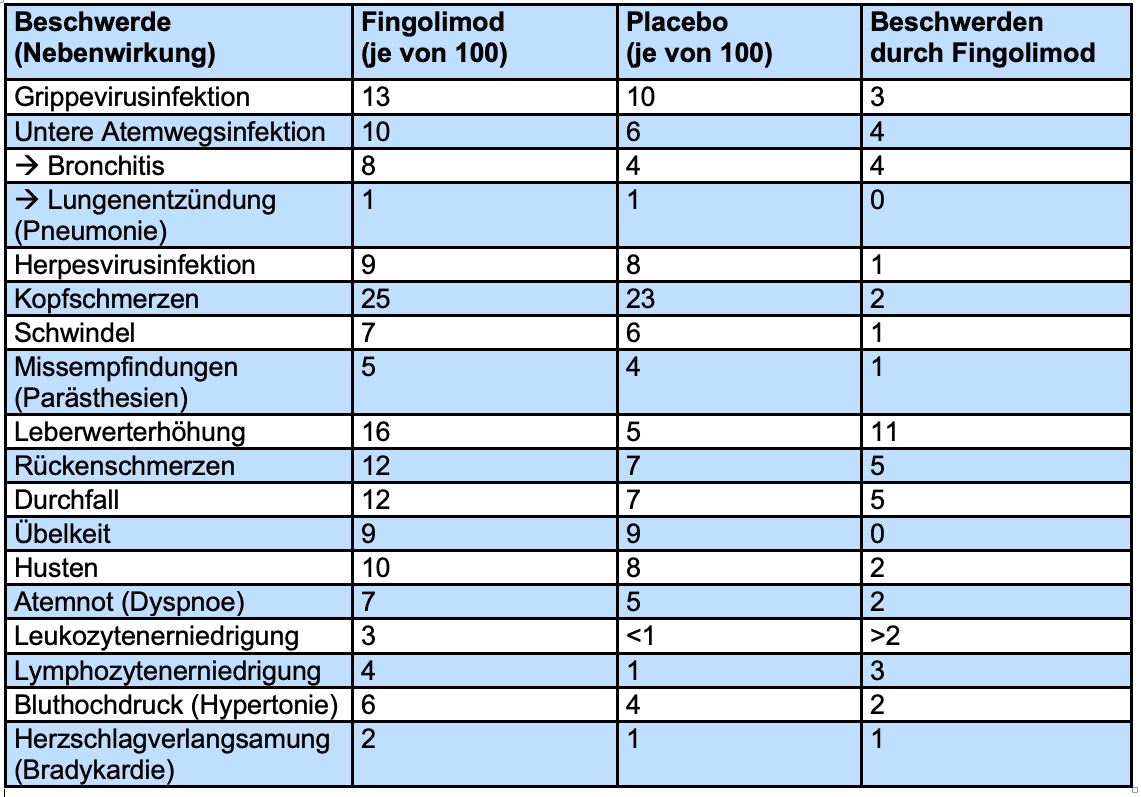
Untere Atemwegsinfektionen
Untere Atemwegsinfektionen traten signifikant häufiger auf bei Patienten, die Fingolimod nahmen, im Vergleich zu den Patienten der Placebo-Gruppe. Unter unteren Atemwegsinfektionen wurden auch Lungenentzündungen und Bronchitiden (Verlinkung) gezählt. Es gab 34 Patienten (8%) der Fingolimod-Gruppe, die über eine Bronchitis berichteten, und 15 Patienten (4%) der Placebo-Gruppe. Dieser Unterschied war signifikant.
Lungenentzündungen (Pneumonien)
Lungenentzündungen traten in der Zulassungsstudie bei 4 Patienten (1%) der Fingolimod-Gruppe und 3 Patienten (1%) der Placebo-Gruppe auf. Bei der Verlängerungsstudie FREEDOMS II (Verlinkung?) aber wurde eine signifikant erhöhte Zahl von Lungenentzündungen bei Fingolimod festgestellt mit 5 Fällen (1%) gegenüber keinem (0%) unter Placebo.
Durchfall
Genauere Informationen zur Schwere der berichteten Durchfallerkrankung liegen nicht vor. Sie trat bei 7 von 100 Patienten der Placebo-Gruppe und 12 von 100 Patienten der Fingolimod-Gruppe auf. Dieser Unterschied war signifikant.
Leberwerterhöhung
Ein häufig genutzter Leberwert, die sogenannte Alanin-Aminotransferase (auch ALT, ALAT oder GPT abgekürzt), erreichte in 9% der Fingolimod-Gruppe und 2% der Placebo-Gruppe Werte, die das Dreifache der normalen Obergrenze betrugen. Dieser Unterschied war signifikant. Bei einem Patienten der Fingolimod-Gruppe erreichten die Werte das 10-fache der Obergrenze. Bei allen Patienten normalisierten sich die Leberwerte nach einiger Zeit wieder, auch bei denen, die das Medikament trotz der Erhöhung ihrer Leberwerte nicht absetzten, sondern weiter einnahmen. Die Veränderung des Leberwertes ALT trat besonders häufig bei Männern auf.
Weitere Nebenwirkungen:
Weitere Nebenwirkungen wurden den Zulassungsstudien FREEDOMS I, FREEDOMS II, TRANSFORMS[21] und der Gilenya-Fachinformation entnommen. Wenn nicht anders beschrieben, beziehen sich die Zahlen auf die FREEDOMS I Studie.
Herzschlagverlangsamung
Eine Verlangsamung des Herzschlags (Bradykardie) trat bei 9 Patienten (2%) der Fingolimod-Gruppe und 3 Patienten (1%) der Placebo-Gruppe auf. Dieser Unterschied war nicht signifikant. Die meisten Fälle traten in den ersten 6 Stunden, nachdem das Medikament neu gegeben wurde, auf. Alle normalisierten sich innerhalb von 24 Stunden wieder. Die Verlangsamung des Herzschlags betrug im Durschnitt 12-13 Schläge pro Minute. Das sind ca. 20% eines normalen Herzrhythmus von 60-80 Schlägen pro Minute. Bei regelmäßiger Einnahme ging die durchschnittliche Herzfrequenz innerhalb eines Monats wieder auf den Ausgangswert zurück.
Bluthochdruck (Hypertonie)
In der Verlängerungsstudie FREEDOMS II (Verlinkung/siehe Kapitel ... weiter oben) wurden bei 3% der Placebo-Patienten und 9% der Fingolimod-Patienten Blutdruckerhöhungen beobachtet. Es gab einen sehr geringen Anstieg des Blutdrucks (Verlinkung?) bei allen Patienten, der sich ca. einen Monat nach Therapiebeginn zeigte und während der Behandlung bestehen blieb.
Augenhintergrundveränderungen
Eine Veränderung des Augenhintergrunds mit Wassereinlagerung an der Stelle des schärfsten Sehens (auch Makulaödem) genannt, kam in der Zulassungsstudie in 7 Fällen vor. Alle davon waren in der Gruppe, die die in Deutschland nicht zugelassene Dosis 1,25 mg Fingolimod erhielten. 6 dieser Fälle normalisierten sich 1 bis 6 Monate, nachdem die Therapie abgebrochen wurde. In der Verlängerungsstudie trat ein Makulaödem bei einem Patienten (0,3%) der Placebo-Gruppe und einem Patienten (0,3%) der 0,5mg-Fingolimod-Gruppe auf. Die meisten Fälle traten 3-4 Monate nach Behandlungsbeginn auf.
Schwere Nebenwirkungen und Todesfälle
In der Zulassungsstudie traten 3 Todesfälle auf. Zwei verstorbene Patienten waren in der Placebo-Gruppe und kamen durch einen Autounfall und eine Lungenembolie ums Leben, einer war in der 1,25mg-Fingolimod Gruppe und starb durch einen Suizid. In der Verlängerungsstudie kam es in einigen Fällen zu Herzrhythmusstörungen. Einen AV-Block (Verlinkung) 1. Grades hatten 17 Patienten (5%) der Fingolimod-Gruppe und 7 Patienten (2%) der Placebo-Gruppe. Ein AV-Block 2. Grades trat bei 7 Patienten (2%) der Fingolimod-Gruppe und 0 Patienten (0%) der Placebo-Gruppe auf. Alle Fälle traten während der 1. Gabe des Medikaments innerhalb der Beobachtungszeit auf und bildeten sich spontan zurück.
Krebserkrankungen
In der Zulassungsstudie FREEDOMS und in der TRANSFORMS-Studie (Velrinkung) traten keine Häufungen von Krebserkrankungen auf. In der Zulassungsstudie FREEDOMS bekamen 1 Patient der 1,25mg Fingolimod Gruppe, 4 Patienten der 0,5mg Fingolimod Gruppe und 3 Patienten der Placebo Gruppe ein Basalzellkarzinom.
Jedoch wurde in der Verlängerungsstudie FREEDOMS II unter Einnahme von Fingolimod eine Häufung von Basalzellkarzinomen (Verlinkung?) beobachtet. Dies ist eine bestimmte Art von Hautkrebs. Hier gab es in der Fingolimod-Gruppe 10 Fälle (2,8%) und in der Placebo-Gruppe 2 Fälle (0,6%). Dieser Unterschied war statistisch signifikant, d.h. dieser Studie nach traten Krebserkrankungen bei Fingolimod-Einnahme gehäuft auf.
Andere Krebsarten, die in der Zulassungsstudie auftraten, waren:
- Brustkrebs (1 Patient der 1,25mg Fingolimod-Gruppe, 3 Patienten der Placebo-Gruppe),
- Hautkrebse (ein Patient mit Morbus Bowen in der 1,25mg-Fingolimod-Gruppe, 2 Patienten mit malignen Melanomen, davon jeweils 1 Patient der 1,25mg-Fingolimod-Gruppe und 1 Patient der Placebo Gruppe)
- Gebärmutterhalskrebs (1 Patient der Placebo-Gruppe),
- Gebärmutterschleimhautkrebs (1 Patient der Placebo-Gruppe) und
- Prostatakrebs (1 Patient der Placebo-Gruppe).
Möglicherweise besteht unter Einnahme von Fingolimod ein geringfügig erhöhtes Risiko für Lymphdrüsenkrebs im Vergleich zur Normalbevölkerung. Die bisherigen Daten reichen nicht aus, um ein sicher erhöhtes Krebserkrankungsrisiko unter Fingolimod zu belegen. Es ist aber zu beachten, dass alle Medikamente, die das Immunsystem beeinflussen, das Krebsrisiko erhöhen können. Dies kann aber nur in Langzeitstudien geklärt werden.
Infektionen
In der Zulassungsstudie gab es keinen statistischen Unterschied des insgesamten Auftretens von Infektionen zwischen den Gruppen. Es kam in der Verlängerungsstudie FREEDOMS II aber signifikant häufiger zu schweren Infektionen, wobei es in der Fingolimod-Gruppe 11 (3%) schwere Infektionen gab und in der Placebo-Gruppe 4 (1%).
In der vergleichenden Zulassungsstudie TRANSFORMS (siehe weiter unten im Kapitel ...) traten zwei tödliche Gehirnentzündungen (Enzephalitiden – Verlinkung?) in der 1,25mg-Fingolimod-Gruppe auf. Eine davon hatte den Viruserreger Varizella zoster (Windpocken), und eine hatte den Viruserreger Herpes simplex. Einige weitere tödliche Herpes-Simplex-Infektionen wurden nach Markteinführung gemeldet.
Es ist zu beachten, dass alle Medikamente, die das Immunsystem beeinflussen, das Infektionsrisiko erhöhen können. Auch dies kann nur in Langzeitstudien geklärt werden.
Welche neuen Nebenwirkungen wurden nach Abschluss der Zulassungsstudien berichtet?
Progressive multifokale Leukenzephalopathie (PML)
Bei der Behandlung mit Fingolimod erkrankten bislang 24 Patienten auf über 267.000 behandlete Fälle an einer Viruserkrankung des Gehirns, der progressiven multifokalen Leukenzephalopathie (PML). Die PML tritt nur bei Menschen mit geschwächter Abwehr auf und kann zu schweren Behinderungen führen oder sogar tödlich sein. Bei 15 von diesen Fällen liegen Daten vor, wie sich die Erkrankung entwickelt hat. 3 von diesen 15 starben an den Folgen der PML. Möglicherweise steht das Risiko einer PML bei Fingolimod im Zusammenhang mit einer deutlich reduzierten Lymphozytenzahl.
Nach Übereinkunft von MS-Spezialisten und Behörden wurde der untere Grenzwert für Lymphozyten auf 500 pro Mikroliter (μl) festgelegt. Dieser Wert sollte nicht dauerhaft unterschritten werden. Zwischen 500 und 800/μl wird eine stärkere Überwachung empfohlen. Es ist dabei aber zu bedenken, dass die im Blut gemessene Anzahl der Lymphozyten nur einen groben Anhalt darüber geben kann, ob die Abwehrfunktionen des Immunsystems, beispielsweise gegen das PML-Virus, intakt sind.
Hämophagozytisches Syndrom
Ein Hämophagozytisches Syndrom ist eine seltene Erkrankung, die mit einer überschießenden Immunreaktion einhergeht, deren genaue Entstehung und Ablauf aber noch unerforscht ist. Es gab 2 Fälle von Patienten, die Fingolimod nahmen, die tödlich endeten.
