Bei wie vielen Patienten traten Nebenwirkungen auf?
In der Zulassungsstudie CLARITY[90] hatten 347 (81%) der Patienten in der Cladribin-Gruppe Nebenwirkungen und 319 (73%) der Patienten in der Placebo-Gruppe. Dieser Unterschied war statistisch signifikant.
Grundsätzlich ist wichtig zu wissen, dass Nebenwirkungen in Studien nicht nur bei den Patienten auftreten, die ein neues Medikament erhalten, sondern auch in der Studiengruppe mit einem bekannten Medikament oder Placebo.
Bei wie vielen Patienten führten die Nebenwirkungen zum Therapieabbruch?
Bei 9 (2%) Patienten in der Placebo-Gruppe und bei 15 (3,5%) in der Cladribin-Gruppe führten die Nebenwirkungen zum Abbruch der Behandlung. Dieser Unterschied war jedoch nicht statistisch signifikant.
Häufige Nebenwirkungen
In der Tabelle sind Nebenwirkungen aufgeführt, die aus der Studie CLARITY[90] berichtet wurden und bei mindestens 2% der Patienten auftraten. Angegeben ist die Patientenzahl von 100 Patienten. In der Grafik zu Anfang des Kapitels sowie in der Faktenbox weiter unten werden jedoch lediglich die wichtigsten Nebenwirkungen dargestellt.
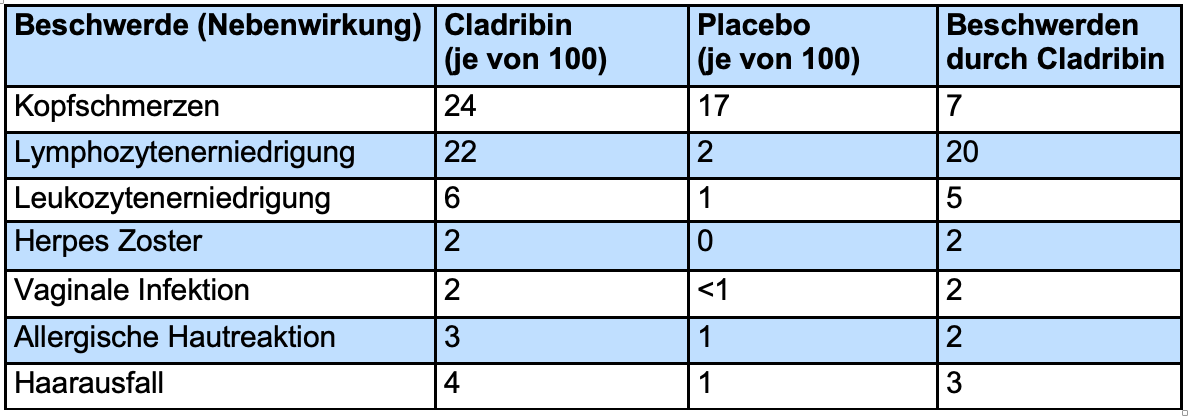
Kopfschmerzen traten in der Placebo-Gruppe bei 17%, in der Cladribin-Gruppe bei 24% auf, sprich es gab einen Unterschied von 7%.
Eine deutliche, jedoch vorübergehende Verminderung der Zahl der Lymphozyten [unter 500 Zellen pro Mikroliter (μl)] trat bei 20 von 100 Patienten nach Cladribin-Gabe auf und ist durch den Wirkmechanismus des Medikaments bedingt. Am Ende der zweijährigen Therapiestudie lag der Wert im Mittel bei 900 Zellen/μl, also knapp unter dem Normbereich von 1500-300 μl. Auch eine vorübergehende Erniedrigung der Gesamtzahl der weißen Blutkörperchen (Leukozyten) unter 3.000 Zellen/μl war in der Cladribin-Gruppe mit 5 von 100 Patienten häufiger als in der Placebo-Gruppe. Dennoch kam es insgesamt nicht gehäuft zu Infektionen. Allerdings litten mehr Patienten in der Cladribin-Gruppe unter einem Herpes zoster (Gürtelrose) (2 von 100) sowie vaginalen Infektionen (2 von 100).
Zusätzlich trat bei 2 von 100 Patienten in der Cladribin-Gruppe eine allergische Hautreaktion (allergische Dermatitis) auf und bei 2 von 100 kam es zu Haarausfall.
Schwere Nebenwirkungen und Todesfälle
In diesem Abschnitt werden nicht nur die schweren Nebenwirkungen (z.B. lebensbedrohliche Erkrankungen) berichtet, die unter der heute zugelassenen Cladribin-Dosis von 3,5mg pro kg Körpergewicht (KG) auftraten, sondern auch die, die bei der höheren getesteten Gesamtdosis von insgesamt 5,25 mg / kg Körpergewicht (KG) auftraten.
In der Placebo-Gruppe kam es bei 6,4%, in der Cladribin-Gruppe bei 8,7% der Patienten zu schweren Nebenwirkungen, d. h. sie kamen bei Cladribin-Einnahme nicht gehäuft vor.
Während und nach der Studie traten insgesamt 6 Todesfälle auf, jeweils 2 in jeder Behandlungsgruppe. Die Ursachen waren:
- in der Placebo-Gruppe ein Suizid und ein Schlaganfall
- in der 3,5 mg / kg KG-Cladribin-Gruppe ein Herzinfarkt und ein Tod aufgrund einer Bauchspeicheldrüsenkrebserkrankung nach Studienende
- in der 5,25 mg / kg KG-Cladribin-Gruppe: ein Todesfall durch Ertrinken und einer durch einen Herzinfarkt nach Studienende
Krebserkrankungen
Während der Zulassungsstudie (CLARITY[90]) traten bei den Patienten, die 3,5 mg / kg Körpergewicht Cladribin erhielten, 3 bösartige Tumore auf: 1 Bauchspeicheldrüsenkrebs, 1 Melanom (schwarzer Hautkrebs) und 1 Eierstockkrebs.
Nach der Studie erkrankte eine Patientin der 5,25 mg / kg Körpergewicht-Cladribin-Gruppe an einem Krebs, der sich bei einer Schwangerschaft am Mutterkuchen bilden kann. In der Placebo-Gruppe traten keine Krebserkrankungen auf.
In der Studie mit ersterkrankten Patienten (ORACLE) trat bei 5,25 mg / kg Cladribin ein Gebärmutterkrebs auf, bei 3,5 mg / kg Cladribin 1 Schilddrüsenkrebs und 2 Hauttumore. Bei Placebo-Gabe traten 3 gutartige Schilddrüsentumore auf.
Statistisch gesehen traten die Krebserkrankungen bei Cladribin-Tabletten-Einnahme nicht gehäuft auf. Dennoch ist zu beachten, dass alle Medikamente, die das Immunsystem beeinflussen, das Krebsrisiko erhöhen können. Dies kann aber nur in Langzeitstudien geklärt werden.
Infektionen
Wenn man alle Arten von Infekten zusammenzählt, traten diese bei Cladribin-Gabe nicht häufiger auf als bei den Patienten, die ein Placebo erhielten. Es kam jedoch bei einer Patientin zu einer Reaktivierung einer nicht bekannten Tuberkulose.
In der Therapie der Haarzellleukämie mit Cladribin wurden Fälle einer gefährlichen Gehirnentzündung, der Progressiven Multifokalen Leukenzephalopathie, kurz PML, berichtet. Bei MS-Patienten gab es bisher, in 12 Jahren klinischer Erfahrung, nach Cladribin-Gabe aber keine PML-Fälle.
Dennoch ist zu beachten, dass alle Medikamente, die das Immunsystem beeinflussen, auch das Infektionsrisiko erhöhen können. Wenn die Lymphozyten unter eine bestimmte Schwelle sinken (< 200 Zellen/μl), wird daher auch eine vorbeugende Herpesvirustherapie empfohlen (siehe unten).
Welche neuen Nebenwirkungen wurden nach Abschluss der Zulassungsstudien berichtet?
Neue Nebenwirkungen wurden bisher nicht berichtet. In der Verlaufsstudie, bei der ein Teil der Patienten bis zu vier Jahre am Stück mit Cladribin behandelt wurde, bestätigten sich die bekannten Nebenwirkungen. Bis dahin unbekannte Nebenwirkungen traten nicht auf.
