Bei wie vielen Patienten traten Nebenwirkungen auf?
Laut der Zulassungsstudie AFFIRM[57] hatten 596 (95%) der Patienten in der Natalizumab-Gruppe Nebenwirkungen und 312 (96%) der Patienten in der Placebo-Gruppe. Dieser Unterschied war nicht signifikant.
Grundsätzlich ist wichtig zu wissen, dass Nebenwirkungen in Studien nicht nur bei den Patienten auftreten, die ein neues Medikament erhalten, sondern auch in der Studiengruppe mit einem bekannten Medikament oder Placebo.
Bei wie vielen Patienten führten die Nebenwirkungen zum Therapieabbruch?
Bei 12 (4%) Patienten in der Placebo-Gruppe und bei 36 (6%) in der Natalizumab-Gruppe führten die Nebenwirkungen zum Abbruch der Behandlung.
Häufige Nebenwirkungen
In der Tabelle ist dargestellt, wie viel häufiger Nebenwirkungen in der Natalizumab-Gruppe als in der Placebo-Gruppe auftraten. Aufgeführt sind Nebenwirkungen, die aus der Zulassungsstudie AFFIRM berichtet wurden und bei mindestens 2% der Patienten auftraten. Angegeben ist die Patientenzahl von 100 Patienten.
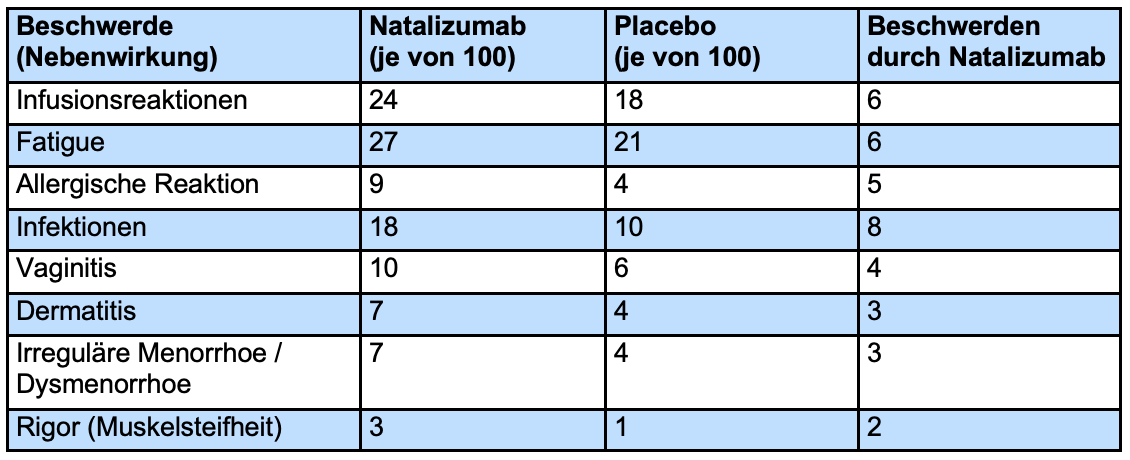
Infusionsreaktion
Infusionsreaktionen innerhalb von 2 Stunden nach Infusion waren häufiger unter Natalizumab zu beobachten. Am häufigsten traten Kopfschmerzen auf.
Fatigue
Signifikant mehr Patienten unter Natalizumab klagten über Fatigue. Genauere Daten hierzu liegen nicht vor.
Allergische Reaktionen
Allergische Reaktionen waren häufiger unter Natalizumab. Diese waren umschrieben oder am ganzen Körper verteilt Nesselsucht oder Ekzeme. 5 dieser 25 Fälle mit allergischen Reaktionen hatten mehrere allergische Beschwerden und wurden als Anaphylaxie gewertet. Diese traten spätestens nach der 13. Infusion auf.
Laborwertveränderungen
Zwischen den Behandlungsgruppen gab es keine signifikanten Unterschiede in den Laborwerten.
Neutralisierende Antikörper
57 (9%) der Patienten unter Natalizumab entwickelten Antikörper gegen das Medikament. Bei 37 Patienten (6%) waren diese wiederholt nachweisbar und führten zu verstärkten Infusionsreaktionen. Diese werden dann als allergische Reaktionen aufgefasst. Die Antikörper führen zum Wirkungsverlust von Natalizumab (siehe auch weiter unten im Kapitel „Häufig gestellte Fragen“).
Infektionen
Infekte traten bei der Therapie mit Natalizumab etwas häufiger auf. Dies waren Atemwegsinfektionen, Grippe, Hautinfektionen, Scheideninfektionen und Blasenentzündungen. In der oben stehenden Tabelle wurden Daten zu Harnwegsinfekten, Scheideninfektionen und Hautinfektionen zusammengefasst.
In der Natalizumab-Gruppe kam es genauso häufig wie in der Placebo-Gruppe zu ernsten Infektionen (Lungenentzündung).
Schwere Nebenwirkungen und Todesfälle
Durch Natalizumab bedingte schwere Nebenwirkungen traten in den Studien nicht gehäuft auf. In der Natalizumab-Gruppe kam es zu 2 Todesfällen, einer durch eine Alkoholvergiftung, einer durch eine Hautkrebserkrankung.
Krebserkrankungen
In der Natalizumab-Gruppe traten 5 Krebserkrankungen auf und in der Placebo-Gruppe eine. Dieser Unterschied war statistisch nicht signifikant, d.h. Krebserkrankungen traten bei Natalizumab-Einnahme nicht gehäuft auf. In der Placebo-Gruppe trat ein Hautkrebs auf, unter der Einnahme von Natalizumab 3 Brustkrebserkrankungen, 1 Hautkrebs und 1 Gebärmutterhalskrebs. 12 Jahre nach Zulassung gibt es keine Hinweise auf ein erhöhtes Krebsrisiko. Dennoch ist zu beachten, dass alle Medikamente, die das Immunsystem beeinflussen, das Krebsrisiko erhöhen können. Dies kann aber nur in Langzeitstudien geklärt werden.
Welche neuen Nebenwirkungen wurden nach Abschluss der Zulassungsstudien berichtet?
Risiko einer schweren Hirnentzündung durch das JC-Virus (PML=Progressiv multiofokale Leukenzephalopathie)
Mittlerweile (Stand: 14.12.2018) liegen 804 Fälle einer PML auf 193.800 mit Natalizumab behandelte Patienten vor. Basierend auf diesen 804 Fällen liegt das geschätzte Gesamtrisiko einer PML derzeit bei vier (4,1) Fällen pro 1.000 Patienten, das heißt etwa einer von 250 Behandelten entwickelt eine PML. Damit handelt es sich bei dieser Komplikation um eine gelegentlich auftretende Nebenwirkung, wobei das individuelle Risiko über bekannte Risikofaktoren abgeschätzt werden kann. Ganz wichtig ist dabei, ob sich der Körper schon einmal mit dem JC-Virus auseinandergesetzt hat, der sogenannte JC-Antikörperstatus, gemessen als JCV-Antikörperindex (siehe dazu auch weiter unten im Kapitel "Worauf muss bei der Therapie mit Natalizumab geachtet werden?"). Wenn der Status negativ ist, ist das PML-Risiko ist deutlich niedriger.
Diese Komplikation trat zunächst in der Verlängerungsphase der SENTINEL-Studie[58] auf. Bei zwei von 589 Patienten in der Gruppe, die Avonex® und Tysabri® erhielten, entwickelte sich eine schwere Entzündung des Gehirns (Progressive Multifokale Leukenzephalopathie, PML). Ein Patient überlebte die Infektion mit schweren bleibenden Beeinträchtigungen, eine Patientin verstarb an der PML. Nach Bekanntwerden der beiden PML-Fälle wurden die Studien gestoppt und der Vertrieb des Medikaments 2005 vorläufig eingestellt. Seit 2007 wird Tysabri® wieder vermarktet, die Entwicklung der PML-Fälle wird beobachtet. Mittlerweile (Stand: 14.12.2018) liegen jedoch 804 Fälle von 193.800 Behandelten vor. Basierend auf diesen 804 Fällen liegt das geschätzte Gesamtrisiko einer PML derzeit bei vier (4,1) Fällen pro 1.000 Patienten, das heißt etwa einer von 250 Behandelten entwickelt eine PML. Damit handelt es sich bei dieser Komplikation um eine gelegentlich auftretende Nebenwirkung, wobei das individuelle Risiko über bekannte Risikofaktoren abgeschätzt werden kann. Ganz wichtig ist dabei, ob sich der Körper schon einmal mit dem JC-Virus auseinandergesetzt hat, der so genannte JC-Antikörperstatus, gemessen als JCV-Antikörperindex (siehe unten unter PML-Risiko 3.). Wenn der Status negativ ist, hatte dieser Patient noch keine Berührung mit dem JC-Virus, das PML-Risiko ist dann deutlich niedriger.
Detailliertere Informationen zur PML finden Sie im Glossar.
