Natalizumab (Tysabri®)
Natalizumab ist zugelassen für Erwachsene mit hochaktiver, schubförmig remittierend verlaufender Multipler Sklerose (MS). Es wird als Infusion alle 4 Wochen verabreicht. Bei einem Teil der Patienten reduziert Natalizumab die Schubrate und bremst die Zunahme der MS-bedingten Beeinträchtigungen. An wichtigen Nebenwirkungen treten auf: allergische Reaktionen und gelegentlich die progressive multifokale Leukenzephalopathie (PML). Zur Überwachung muss eine Risikoerkennung für PML mit Bluttest und MRT, evtl. auch eine Nervenwasserentnahme durchgeführt werden. Das Medikament wird in der Apotheke unter dem Namen Tysabri® vertrieben.
Wirkungen & Nebenwirkungen im grafischen Überblick
Schubfreie Patienten
Patienten ohne Zunahme der Behinderung

Was ist Natalizumab?
Natalizumab ist ein gentechnisch hergestellter, humanisierter Antikörper. Es handelt sich hierbei um sogenannte monoklonale Antikörper, das heißt, sie entstammen einer ("mono") gemeinsamen Zelllinie (sogenannte Zellklone). Diese Zellklone gehen aus einer Urspungszelle hervor. Sie haben die Fähigkeit, sich an eine spezielle Stelle der Außenhülle anderer Zellen zu binden und diese dadurch zu aktivieren oder auch zu zerstören. Bei Natalizumab kommt nur eine wichtige Bindungsstelle von Mäusen, gentechnisch, d.h. ein Großteil ist identisch mit menschlichen (humanisierten) Antikörpern.
Wie wirkt Natalizumab?
Natalizumab ist ein Antirköper, der sich an weiße Blutkörperchen (Leukozyten) bindet, die an MS-bedingten Entzündungsprozessen beteiligt sind.
Natalizumab blockiert eine Bindungsstelle auf Lymphozyten, eine Untergruppe der Leukozyten. Diese Bindungsstelle ist wichtig, um die Zellen durch Blutgefäßwände ins Gehirn wandern zu lassen. Mit angelagerten Antikörpern können diese Leukozyten nicht bis ins Gehirn vordringen. Damit kann Natalizumab die Entzündungsreaktion im Gehirn drosseln.
Entzündungsprozesse bei MS, die zu Schüben und zunehmender Beeinträchtigung führen, sollen auf diese Weise verringert bzw. verhindert werden. Andererseits blockiert Natalizumab auch die Infektabwehr durch diese Immunzellen im Gehirn.
Für wen ist Natalizumab zugelassen?
Seit Sommer 2006 ist Natalizumab in Deutschland von der europäischen Zulassungsbehörde (EMA) „zur Behandlung von erwachsenen Patienten mit hochaktiver schubförmig remittierend verlaufender Multipler Sklerose“ zugelassen. Für genauere Informationen siehe weiter unten im Kapitel „Welche Zulassungsstudien wurden durchgeführt?“.
Wie wird Natalizumab verabreicht?
Natalizumab sollte nur in Zentren mit Erfahrung in der Gabe von Antikörpertherapien und mit der Möglichkeit einer sofortigen Notfallversorgung gegeben werden.
Es wird einmal im Monat als 300 mg (15 ml) Konzentrat in 100 ml Kochsalzlösung verdünnt und dann über ca. 60 Minuten als Kurzinfusion gegeben.
Hier sehen Sie ein Foto des Infusionsfläschchens (links) sowie der Medikamentenpackung (rechts) von Tysabri®.
Bildquelle:http://www.pharmafile.com/news/176760/biogen-and-elan-file-tysabri-first-line-use-ms
Wie wirksam ist Natalizumab bei schubförmiger MS?
Im Folgenden sind die Wirkungen auf der Basis der Studie AFFIRM[57] dargestellt.
1. Wirkung auf die Schubfreiheit
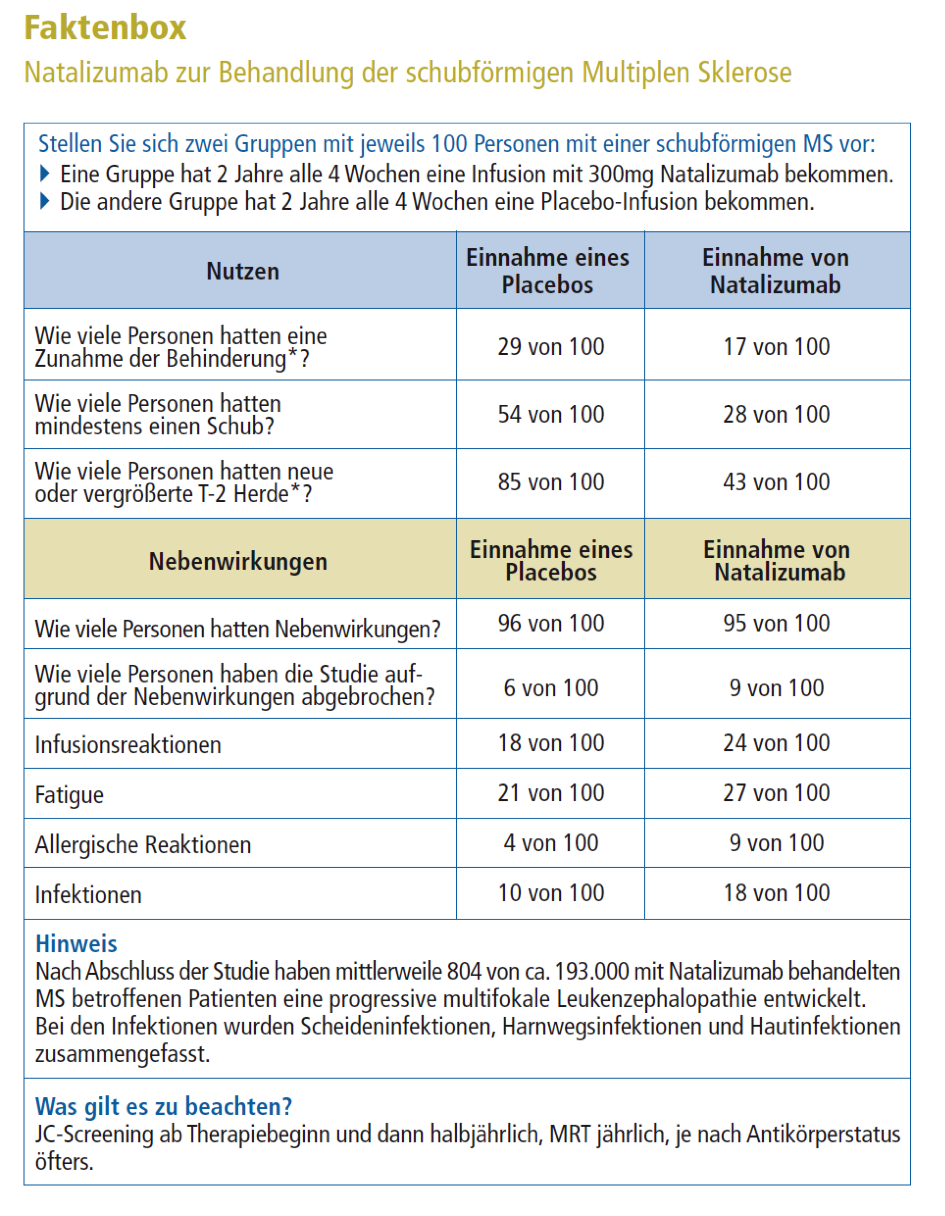
Die Grafik am Kapitelanfang zeigt, wie viele Patienten nach 2 Jahren Therapie mit Natalizumab oder Einnahme von Placebo noch schubfrei waren. Daraus lässt sich der absolute Nutzen (absolute Risikoreduktion) und der relative Nutzen (relative Risikoreduktion) berechnen.
Hier wird die Anzahl der Patienten mit Schüben beschrieben. Um Studienergebnisse mit unterschiedlichen Teilnehmerzahlen besser vergleichen zu können, werden die Ergebnisse bezogen auf 100 Patienten dargestellt:
Der tatsächliche Therapieeffekt zeigt sich, wenn man die Anzahl der Patienten mit Schüben bei Natalizumab-Gabe (28) von denen bei Placebo (54) abzieht. Hier profitieren 54 – 28, also 26 von 100 Patienten von der Therapie. Das entspricht dem absoluten Nutzen (oder auch der absoluten Risikoreduktion).
- 26 von 100 Patienten haben einen Nutzen von der Therapie.
- 28 von 100 Patienten profitieren nicht von der Therapie, da sie trotz der Einnahme von Natalizumab einen Schub hatten.
- 46 von 100 Patienten profitieren nicht, da sie auch ohne Natalizumab schubfrei geblieben sind.
2. Wirkung auf die Anzahl der Schübe pro Jahr
Die jährliche Schubrate zeigt, wie viele Schübe durchschnittlich pro Jahr pro Patient auftraten. Sie lag in der Placebo-Gruppe bei 0,73 Schüben gegenüber 0,23 in der Natalizumab-Gruppe. Etwas verständlicher ausgedrückt: Die Patienten in der Placebo-Gruppe haben im Durchschnitt alle 1,4 Jahre einen Schub, die Patienten in der Natalizumab-Gruppe nur alle 4,3 Jahre.
3. Wirkung auf die Zunahme der Behinderung
Die Zunahme der Behinderung wurde in den Zulassungsstudien mit Hilfe des EDSS gemessen, einer Behinderungsskala von 0 bis 10 (wobei 0 keiner Behinderung, 10 Tod entspricht).
Die Grafik am Kapitelanfang zeigt, wie viele Patienten nach 2 Jahren Therapie mit Natalizumab oder Gabe von Placebo keine Zunahme der Behinderung hatten. Dargestellt ist wieder der absolute Nutzen (absolute Risikoreduktion) und der relative Nutzen (relative Risikoreduktion).
Im Glossar finden Sie Angaben zum Nutzen von Medikamenten bei anderen Erkrankungen. So bekommen Sie einen Eindruck davon, wie groß die Therapieeffekte bei MS im Vergleich zu denen bei anderen Krankheiten sind.
Im Folgenden wird die Entwicklung der Behinderung in zwei Jahren beschrieben, jeweils bezogen auf 100 Patienten:
- 17 von 100 Patienten haben trotz der Natalizumab-Therapie eine Zunahme der Behinderung.
- 71 von 100 Patienten profitieren nicht von der Therapie, sie haben unabhängig von der Therapie keine Zunahme der Behinderung.
- 12 von 100 Patienten haben durch die Einnahme von Natalizumab keine Zunahme der Behinderung.
Der tatsächliche Therapieeffekt zeigt sich, wenn man die Anzahl von Patienten mit einer Behinderungszunahme in der Natalizumab-Gruppe (17) von denen in der Placebo-Gruppe (29) abzieht. Hier profitieren 29 – 17, also 12 von 100 Patienten von der Therapie. Das entspricht dem absoluten Nutzen (oder auch der absoluten Risikoreduktion).
Wirkungen bei sekundär progredienter MS
Die 2018 veröffentlichte ASCEND-Studie (Verlinkung) zur Therapie der sekundär-chronisch progredienten MS (SPMS) konnte keine überzeugende Wirksamkeit von Natalizumab nachweisen. Eine Anwendung im Bereich SPMS ist somit bei bisherigem Datenstand nicht indiziert.
4. Wirkung auf die MRT in zwei Jahren
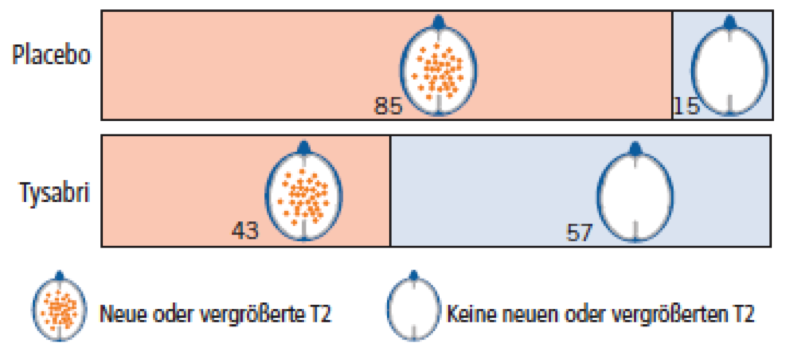
In der MRT treten Kontrastmittelanreicherungen und so genannte T2-Herde auf, die als Ausdruck der Entzündung bei MS betrachtet werden. Dabei können Herde größer werden oder ganz neu auftreten.
15% der Patienten in der Placebo-Gruppe und 57% in der Natalizumab-Gruppe waren über die Studiendauer frei von neuen oder vergrößerten T2-Herden.
72% der Patienten in der Placebo-Gruppe und 97% in der Natalizumab-Gruppe hatten über die Studiendauer keine Herde mit Kontrastmittelanreicherungen.
Da Kontrastmittelanreicherungen nur eine Momentaufnahme sind, stellen wir nur die Entwicklung der T2-Herde im Querschnitt eines Gehirns grafisch dar. Dargestellt ist die Anzahl von 100 Patienten ohne bzw. mit neuen oder vergrößerten Herden.
Im Glossar finden Sie außerdem Daten zu dem Anteil der Patienten, bei denen es über 2 Jahre keine Anzeichen einer Krankheitsaktivität gab ("NEDA - no evidence of disease activity").
Zulassungsstudien
Zulassungsstudien AFFIRM und SENTINEL:
Die Wirkung von Natalizumab auf die Schubrate und die Zunahme der Behinderung wurde in 2 Zulassungsstudien (AFFIRM[57] und SENTINEL[58]) geprüft und die Ergebnisse im Jahr 2006 veröffentlicht. Insgesamt wurden 2113 Patienten mit schubförmiger MS über einen Zeitraum von 2 Jahren untersucht. Eingeschlossen wurden Patienten, die im Jahr vor Studienbeginn mindestens einen Schub hatten.
- In AFFIRM (Natalizumab Safety and Efficacy in Relapsing Remitting Multiple Sclerosis)[57] wurde Natalizumab gegen Placebo geprüft.
Eingeschlossen wurden 942 Betroffene mit schubförmiger MS und mindestens einem Schub im letzten Jahr. Nicht teilnehmen konnten Patienten, die in den 6 Monaten vor Studienbeginn ein Immunmedikament erhalten oder eine mindestens sechsmonatige Immuntherapie durchgeführt hatten. Die Teilnehmer erhielten alle vier Wochen eine Infusion. 627 Teilnehmer erhielten jeweils 300mg Tysabri®, 315 Teilnehmer ein Placebo. - In SENTINEL (Safety and Efficacy of Natalizumab in Combination with Interferon-β-1a in Patients with Relapsing-Remitting Multiple Sclerosis)[58] mussten Patienten darüber hinaus zuvor mindestens 1 Jahr mit einem Interferon behandelt worden sein und unter dieser Therapie einen Schub entwickelt haben, d.h. sie sprachen auf die Interferontherapie nicht ausreichend an. In dieser Studie wurde dann der Hälfte der Patienten zusätzlich zu Interferon-beta1a Natalizumab gegeben, die andere erhielt nur Interferon-beta 1A. Diese Kombination führte jedoch nicht zu einer Zulassung der kombinierten Therapie. Diese Studienergebnisse sind somit für aktuelle Therapieentscheidungen nur begrenzt relevant und werden im Folgenden nicht detailliert beschrieben. Eine PML trat nur in der Verlängerungsphase der SENTINEL-Studie auf. Bei zwei von 589 Patienten in der Gruppe, die Interferon-beta 1a und Natalizumab erhielten, entwickelte sich eine schwere Entzündung des Gehirns (Progressive Multifokale Leukenzephalopathie, PML). Ein Patient überlebte die Infektion mit schweren bleibenden Beeinträchtigungen, eine Patientin verstarb an der PML, die erst nach Ende der zweijährigen Studiendauer aufgetreten war. Nach Bekanntwerden der beiden PML-Fälle wurden die Studien gestoppt und der Vertrieb des Medikaments 2005 vorläufig eingestellt. 2007 wurde Natalizumab wieder vermarktet, die Entwicklung der PML-Fälle wird beobachtet.
Welche Nebenwirkungen hat Natalizumab?
Bei wie vielen Patienten traten Nebenwirkungen auf?
Laut der Zulassungsstudie AFFIRM[57] hatten 596 (95%) der Patienten in der Natalizumab-Gruppe Nebenwirkungen und 312 (96%) der Patienten in der Placebo-Gruppe. Dieser Unterschied war nicht signifikant.
Grundsätzlich ist wichtig zu wissen, dass Nebenwirkungen in Studien nicht nur bei den Patienten auftreten, die ein neues Medikament erhalten, sondern auch in der Studiengruppe mit einem bekannten Medikament oder Placebo.
Bei wie vielen Patienten führten die Nebenwirkungen zum Therapieabbruch?
Bei 12 (4%) Patienten in der Placebo-Gruppe und bei 36 (6%) in der Natalizumab-Gruppe führten die Nebenwirkungen zum Abbruch der Behandlung.
Häufige Nebenwirkungen
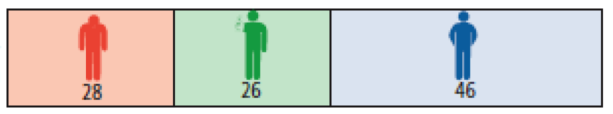
In der Tabelle ist dargestellt, wie viel häufiger Nebenwirkungen in der Natalizumab-Gruppe als in der Placebo-Gruppe auftraten. Aufgeführt sind Nebenwirkungen, die aus der Zulassungsstudie AFFIRM berichtet wurden und bei mindestens 2% der Patienten auftraten. Angegeben ist die Patientenzahl von 100 Patienten.
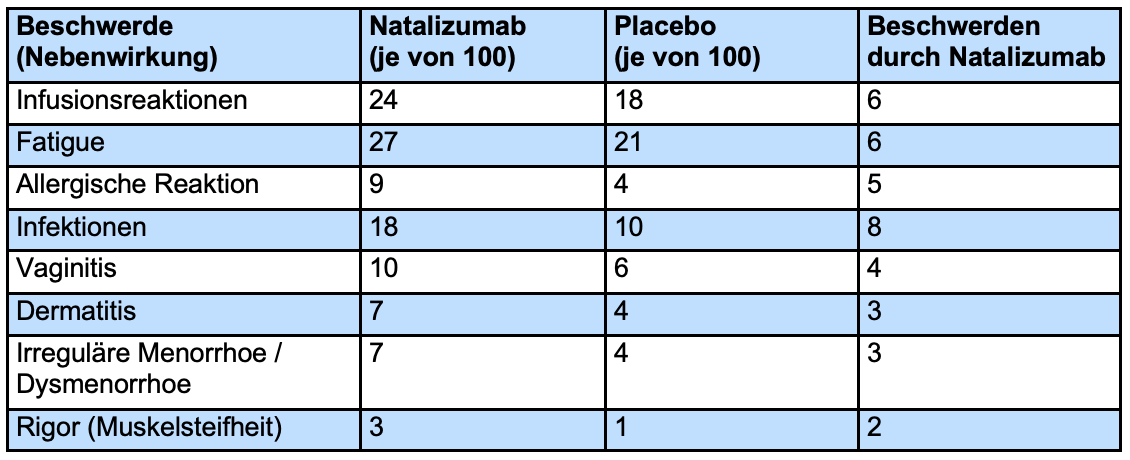
Infusionsreaktion
Infusionsreaktionen innerhalb von 2 Stunden nach Infusion waren häufiger unter Natalizumab zu beobachten. Am häufigsten traten Kopfschmerzen auf.
Fatigue
Signifikant mehr Patienten unter Natalizumab klagten über Fatigue. Genauere Daten hierzu liegen nicht vor.
Allergische Reaktionen
Allergische Reaktionen waren häufiger unter Natalizumab. Diese waren umschrieben oder am ganzen Körper verteilt Nesselsucht oder Ekzeme. 5 dieser 25 Fälle mit allergischen Reaktionen hatten mehrere allergische Beschwerden und wurden als Anaphylaxie gewertet. Diese traten spätestens nach der 13. Infusion auf.
Laborwertveränderungen
Zwischen den Behandlungsgruppen gab es keine signifikanten Unterschiede in den Laborwerten.
Neutralisierende Antikörper
57 (9%) der Patienten unter Natalizumab entwickelten Antikörper gegen das Medikament. Bei 37 Patienten (6%) waren diese wiederholt nachweisbar und führten zu verstärkten Infusionsreaktionen. Diese werden dann als allergische Reaktionen aufgefasst. Die Antikörper führen zum Wirkungsverlust von Natalizumab (siehe auch weiter unten im Kapitel „Häufig gestellte Fragen“).
Infektionen
Infekte traten bei der Therapie mit Natalizumab etwas häufiger auf. Dies waren Atemwegsinfektionen, Grippe, Hautinfektionen, Scheideninfektionen und Blasenentzündungen. In der oben stehenden Tabelle wurden Daten zu Harnwegsinfekten, Scheideninfektionen und Hautinfektionen zusammengefasst.
In der Natalizumab-Gruppe kam es genauso häufig wie in der Placebo-Gruppe zu ernsten Infektionen (Lungenentzündung).
Schwere Nebenwirkungen und Todesfälle
Durch Natalizumab bedingte schwere Nebenwirkungen traten in den Studien nicht gehäuft auf. In der Natalizumab-Gruppe kam es zu 2 Todesfällen, einer durch eine Alkoholvergiftung, einer durch eine Hautkrebserkrankung.
Krebserkrankungen
In der Natalizumab-Gruppe traten 5 Krebserkrankungen auf und in der Placebo-Gruppe eine. Dieser Unterschied war statistisch nicht signifikant, d.h. Krebserkrankungen traten bei Natalizumab-Einnahme nicht gehäuft auf. In der Placebo-Gruppe trat ein Hautkrebs auf, unter der Einnahme von Natalizumab 3 Brustkrebserkrankungen, 1 Hautkrebs und 1 Gebärmutterhalskrebs. 12 Jahre nach Zulassung gibt es keine Hinweise auf ein erhöhtes Krebsrisiko. Dennoch ist zu beachten, dass alle Medikamente, die das Immunsystem beeinflussen, das Krebsrisiko erhöhen können. Dies kann aber nur in Langzeitstudien geklärt werden.
Welche neuen Nebenwirkungen wurden nach Abschluss der Zulassungsstudien berichtet?
Risiko einer schweren Hirnentzündung durch das JC-Virus (PML=Progressiv multiofokale Leukenzephalopathie)
Mittlerweile (Stand: 14.12.2018) liegen 804 Fälle einer PML auf 193.800 mit Natalizumab behandelte Patienten vor. Basierend auf diesen 804 Fällen liegt das geschätzte Gesamtrisiko einer PML derzeit bei vier (4,1) Fällen pro 1.000 Patienten, das heißt etwa einer von 250 Behandelten entwickelt eine PML. Damit handelt es sich bei dieser Komplikation um eine gelegentlich auftretende Nebenwirkung, wobei das individuelle Risiko über bekannte Risikofaktoren abgeschätzt werden kann. Ganz wichtig ist dabei, ob sich der Körper schon einmal mit dem JC-Virus auseinandergesetzt hat, der sogenannte JC-Antikörperstatus, gemessen als JCV-Antikörperindex (siehe dazu auch weiter unten im Kapitel "Worauf muss bei der Therapie mit Natalizumab geachtet werden?"). Wenn der Status negativ ist, ist das PML-Risiko ist deutlich niedriger.
Diese Komplikation trat zunächst in der Verlängerungsphase der SENTINEL-Studie[58] auf. Bei zwei von 589 Patienten in der Gruppe, die Avonex® und Tysabri® erhielten, entwickelte sich eine schwere Entzündung des Gehirns (Progressive Multifokale Leukenzephalopathie, PML). Ein Patient überlebte die Infektion mit schweren bleibenden Beeinträchtigungen, eine Patientin verstarb an der PML. Nach Bekanntwerden der beiden PML-Fälle wurden die Studien gestoppt und der Vertrieb des Medikaments 2005 vorläufig eingestellt. Seit 2007 wird Tysabri® wieder vermarktet, die Entwicklung der PML-Fälle wird beobachtet. Mittlerweile (Stand: 14.12.2018) liegen jedoch 804 Fälle von 193.800 Behandelten vor. Basierend auf diesen 804 Fällen liegt das geschätzte Gesamtrisiko einer PML derzeit bei vier (4,1) Fällen pro 1.000 Patienten, das heißt etwa einer von 250 Behandelten entwickelt eine PML. Damit handelt es sich bei dieser Komplikation um eine gelegentlich auftretende Nebenwirkung, wobei das individuelle Risiko über bekannte Risikofaktoren abgeschätzt werden kann. Ganz wichtig ist dabei, ob sich der Körper schon einmal mit dem JC-Virus auseinandergesetzt hat, der so genannte JC-Antikörperstatus, gemessen als JCV-Antikörperindex (siehe unten unter PML-Risiko 3.). Wenn der Status negativ ist, hatte dieser Patient noch keine Berührung mit dem JC-Virus, das PML-Risiko ist dann deutlich niedriger.
Detailliertere Informationen zur PML finden Sie im Glossar.
Worauf muss bei der Therapie mit Natalizumab geachtet werden?
Unter welchen Umständen sollte Natalizumab nicht verabreicht werden?
Natalizumab sollte nicht verabreicht werden bei
- immungeschwächten Patienten, wie z.B. bei HIV-Infektion
- Patienten mit Tumorerkrankungen
- PML in der Vorgeschichte
Bei Nachweis einer starken körpereigenen Antikörperantwort gegen das JC-Virus (siehe unten: „Kann man das PML-Risiko abschätzen?“), das eine PML auslösen kann, sollte Natalizumab nur in Ausnahmefällen gegeben werden.
Worauf ist bei Therapiebeginn zu achten?
Weil Natalizumab das Immunsystem hemmt, sollten vor Therapiebeginn alle Standardimpfungen durchgeführt werden, die die STIKO (Ständige Impfkommission) für Menschen empfiehlt, deren Immunsystem teilweise blockiert werden soll./>
Bei Patienten, die bereits eine Therapie erhalten haben, die das Immunsystem beeinflusst oder hemmt, müssen Sicherheitsabstände eingehalten werden. Diese richten sich nach der Wirkdauer der Medikamente. Eine Kurzzeitbehandlung mit Kortikosteroiden (Kortison), z.B. zur Schubtherapie, ist auch während der Behandlung möglich.
Welche Sicherheitsabstände müssen eingehalten werden?
Bei Patienten, die bereits eine Therapie erhalten haben, die das Immunsystem beeinflusst oder hemmt, müssen Sicherheitsabstände eingehalten werden. Diese richten sich nach der Wirkdauer der Medikamente. Die Wartezeit beträgt nach der Behandlung mit...
- Fingolimod und Teriflunomid mindestens 4 Wochen.
- Natalizumab mindestens 6-8 Wochen.
- Azathioprin, Ciclosporin A, Cyclophosphamid, Methotrexat und Mitoxantron mindestens 2-3 Monate.
- Cladribin mindestens 6 Monate.
- Alemtuzumab, Ocrelizumab und Rituximab mindestens 6-12 Monate.
Bei der vorherigen Verwendung von Interferonen oder Glatirameracetat müssen, solange sich etwaige Blutbildveränderungen normalisiert haben, keine Sicherheitsabstände eingehalten werden.
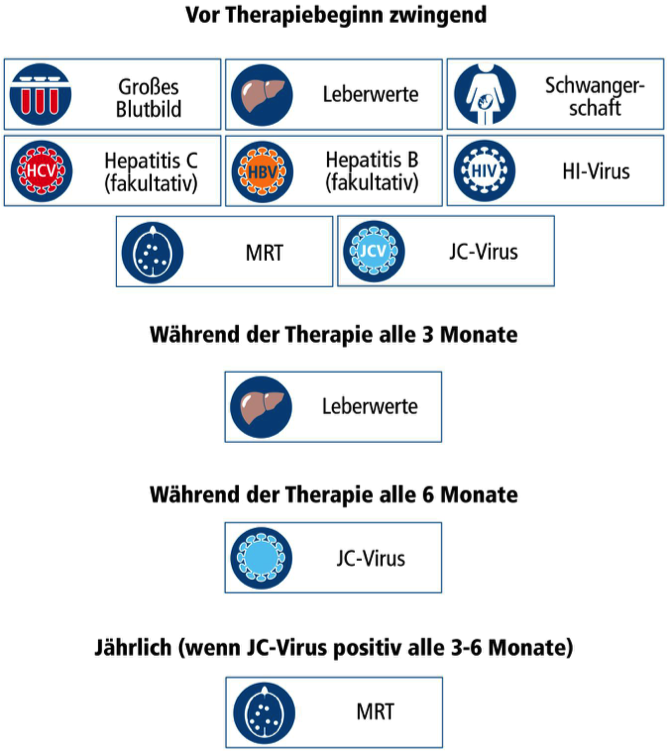
Was muss während der Therapie kontrolliert werden?
Das Krankheitsbezogene Kompetenznetz Multiple Sklerose (KKNMS) empfiehlt:
Kann man das PML-Risiko abschätzen?
Zur Risikoabschätzung sind 3 Faktoren wichtig. Therapiedauer, Vorbehandlung mit Immunsuppressiva und der JCV-Antikörperwert. Dieser Wert zeigt die Menge an Anti-JCV-Antikörpern im Blut (sogenannte Indexwerte) und hängt mit dem Risiko, eine PML zu entwickeln, zusammen. Möglicherweise ist daher eine Zunahme des Antikörper-Indexwertes bei JCV-positiven Patienten bedeutsam. Mit einem niedrigen Antikörperindexwert (< 0,9) besteht demnach bei einem JCV-AK-positiven Patienten innerhalb der ersten beiden Jahre ein ähnliches Risiko wie bei einem JCV-AK-negativen Patienten. Nach der letzten Schätzung von Daten von 125.000 Patienten liegt das Risiko bei negativem Antikörpertest zu erkranken bei 1:10.000. Insgesamt sind weltweit 5 zuerst AK-negative Patienten beschrieben, die dann eine PML entwickelt haben. Bei 4 von diesen Patienten war der AK dann auch positiv. Umgekehrt erhöht ein hoher Antikörperindex (> 1,5) das bisher angenommene Risiko auf 3-10 Fälle/1.000 ab dem 3. Therapiejahr.
1. Therapiedauer
Das Risiko einer PML nimmt mit der Dauer der Natalizumab-Therapie zu. Prinzipiell besteht jedoch auch schon zu Beginn der Behandlung ein Risiko. Im ersten Therapiejahr entwickeln jedoch nur etwa 0,5 von 10.000 Behandelten eine PML, im dritten Jahr sind es etwa 15 auf 10.000 (Stand 28.12.2018). Bei JCV-positiven ist das Risiko 0,6 auf 1.000 in den ersten 2 Jahren, im dritten Jahr dann bei 2 auf 1.000.
2. Immunsuppressive Vortherapie
Eine Vorbehandlung mit einem der Medikamente Mitoxantron, seltener Cylophosphamid, Azathioprin, Mycophenolat-Mofetil oder Methotrexat kann vermutlich das PML-Risiko erhöhen. Bei Vorbehandlung mit einem dieser Medikamente ist das Risiko im ersten Jahr 0,3 auf 1.000, im zweiten Jahr 0,4 auf 1.000, im dritten Jahr dann 4 auf .1000 und im vierten Jahr 8 auf 1.000. Der Effekt einer Vorbehandlung mit den neueren Medikamenten Teriflunomid, Dimethylfumarat, Fingolimod, Alemtuzumab und Ocrelizumab lässt sich noch nicht abschätzen.
3. JC-Antikörperstatus
In Deutschland sind während der Natalizumab-Therapie bei ca. 60% der Patienten Antikörper gegen das JC-Virus nachweisbar. Bei Gesunden entwickeln jährlich ca. 2 von 100 neu eine Antikörperantwort, haben sich also mit dem Virus auseinandergesetzt ohne krank zu werden.
Das Paul-Ehrlich Institut (PEI) als die deutsche Aufsichtsbehörde hat ein Überwachungskonzept mit Ärzten und der Firma Biogen entwickelt. Dafür ist die wiederholte Bestimmung des JCV-AK-Index wichtig.
Darüber hinaus lässt sich mit einem Diagramm das Risiko berechnen:
Dargestellt ist das Risiko auf jeweils 1.000 behandelte Patienten.

Was passiert, wenn man Natalizumab absetzt?
Untersuchungen an 1866 Patienten, bei denen Natalizumab wegen der ersten PML-Fälle 2005 abgesetzt wurde haben gezeigt, dass meist die Krankheitsaktivität wieder auftritt wie vor Natalizumab. Einige kleinere Untersuchungen haben gezeigt, dass bei einigen Patienten die Schubaktivität vorübergehend sogar stärker ausgeprägt sein kann als zuvor. Durch den plötzlichen Wegfall der Hemmung durch Natalizumab kommt es zu einem verstärkten und raschen Einstrom von Entzündungszellen ins Nervensystem. Dieses tritt evtl. schon nach 4 Wochen bis hin zu 6 Monaten nach Absetzen auf.
Sind Unterbrechungen der Natalizumab-Therapie sinnvoll?
Es gibt keine Daten die dafür sprechen, dass durch eine Therapiepause die Häufigkeit von PML-Erkrankungen gesenkt werden kann. Experten empfehlen die Therapie nicht zu unterbrechen, um keinen Verlust der Wirkung zu riskieren.
In der RESTORE-Studie[63] mit 175 Patienten, bei denen die Natalizumabgabe 6 Monate unterbrochen wurde und andere Therapien oder keine Therapie eingesetzt wurde, haben ca. 20% der Patienten innerhalb von 4-8 Wochen nach Absetzen von Natalizumab neue Schübe entwickelt.
Natalizumab - Häufig gestellte Fragen
Wirkt Natalizumab besser oder schlechter als andere MS-Medikamente?
Die Wirksamkeit von Natalizumab alleine ist nie im Verlgeich zu einem anderen MS-Medikament untersucht worden. Allerdings erfolgte in der SENTINEL-Studie[58] eine zusätzliche Tysabri®-Therapie bei Patienten, die unter Avonex®-Therapie weitere Schübe hatten (siehe weiter oben im Kapitel „Welche Zulassungsstudien wurden durchgeführt?“). Die Kombination Tysabri® + Avonex® war dabei wirksamer als Avonex® alleine. Allerdings traten in dieser Kombination die ersten PML-Fälle auf, sodass die Kombination nie zugelassen wurde.
Wie lange wird behandelt?
Natalizumab wird als Therapie zunächst bis zu 2 Jahre eingesetzt. Eine längere Therapie muss sehr sorgfältig abgewogen werden. Nutzen und Risiko der Einnahme müssen laufend überprüft werden. Ein Abschätzen des Nutzens ist aber oft frühestens nach einem Jahr möglich. Als Hinweise für eine Wirksamkeit werden allgemeine Schubfreiheit und das Fehlen neuer Herde in der MRT angesehen. Deshalb empfiehlt das KKNMS eine Ausgangs-MRT und eine MRT nach 6, 12 und 24 Monaten, um Nutzen und auch mögliche Risiken abzuschätzen. Nach 2 Jahren steigt das PML-Risiko (siehe Grafik weiter oben im Kapitel "Worauf muss bei der Therapie mit Natalizumab geachtet werden?"). Hier sollte die Therapie nur bei Patienten ohne Nachweis einer Antikörperbildung gegen das JC-Virus (sogenannte JCV-Antikörper negative Patienten) bzw. in Ausnahmefällen fortgesetzt werden.
Schwangerschaft und Stillzeit
Natalizumab sollte in Schwangerschaft und Stillzeit nicht gegeben werden. Hinweise auf erhöhte Fehlbildungsraten gibt es bisher nicht. Bei strenger Risiko-Nutzen-Abwägung reicht es, mit dem Absetzen der Therapie bis zum Eintritt der Schwangerschaft zu warten. In Ausnahmefällen kann bei hoher Krankheitsaktivität und fehlenden Therapiealternativen die Behandlung mit Natalizumab in der Schwangerschaft fortgesetzt werden. Um Blutbildveränderungen beim Kind zu verhindern, wird empfohlen, Natalizumab vor der 34. Schwangerschaftswoche abzusetzen. Da der Wirkstoff in die Muttermilch übergeht, sollte unter Natalizumab auch nicht gestillt werden.
Impfungen
Bisher sind keine negativen Effekte auf Impferfolge bekannt. Einige wenige Daten sprechen dafür, dass Standardimpfungen unter Natalizumab wirksam bleiben. Sogenannte Lebendimpfstoffe, bei denen lebendige, aber unschädlich gemachte Erreger verwendet werden, sind möglichst zu vermeiden. Natalizumab-Patienten haben möglicherweise keine ausreichende Abwehr und könnten durch die eigentlich harmlosen Impferreger krank werden.
Infektionen
Grundsätzlich muss Natalizumab beim Auftreten üblicher Infekte nicht abgesetzt werden. Bei schweren oder gehäuften Infekten ist im Einzelfall jedoch ein Absetzen in Erwägung zu ziehen.
Neutralisierende Antikörper
Diese Antikörper können den Effekt von Natalizumab aufheben. Wenn unter einer Natalizumab-Therapie eine verstärkte entzündliche Krankheitsaktivität auftritt, muss neben der PML auch ein Wirkungsverlust durch Antikörper diskutiert werden. Hier sollte die Antikörperbestimmung im Blut erfolgen. Bei Nachweis der Antikörper muss der Befund nach 6 Wochen kontrolliert werden. Wenn diese weiter vorliegen, sollte die Therapie mit Natalizumab beendet werden.
Welche Alternativen bestehen zu Natalizumab?
Natalizumab ist nur eine von verschiedenen zugelassenen MS-Therapien. Eine Übersicht finden Sie auf der Hauptseite. Eine weitere Möglichkeit ist auch, keine Immuntherapie durchzuführen.
Ohne Therapie folgt die MS dem natürlichen Verlauf. Wie dieser aussieht, kann man aus den Daten der Placebo-Gruppe in der Zulassungsstudie abschätzen: Über 2 Jahre blieben in der Placebo-Gruppe 46 von 100 Patienten schubfrei und 71 von 100 ohne Zunahme der Behinderung.
Natalizumab - Alles auf einen Blick