Alemtuzumab (Lemtrada®)
Alemtuzumab (Lemtrada®) wird in zwei Zyklen über einen Zeitraum von zwei Jahren verabreicht: Im ersten Jahr erhalten Patienten über 5 Tage das Medikament als Infusion über eine Vene (intravenös), im zweiten Jahr über 3 Tage. Alemtuzumab ist für Patienten mit aktiver schubförmiger MS zugelassen. Es reduziert die Schubrate und hält die Zunahme der Beeinträchtigung auf. Dass Alemtuzumab so selten verabreicht werden muss, liegt daran, dass das Medikament das Immunsystem sehr langfristig beeinflusst.
Die wichtigsten Nebenwirkungen sind: Infusionsreaktionen, Infektionen und sogenannte sekundäre Autoimmunerkrankungen, d.h. durch die Einnahme des Medikaments können z. B. autoimmune Schilddrüsenerkrankungen ausgelöst werden. Dies kann auch lange nach der Behandlung mit Alemtuzumab passieren, sodass vier Jahre nach der letzten Gabe alle 4 Wochen bestimmte Blut- und Urinuntersuchungen durchgeführt werden müssen.
Wirkungen & Nebenwirkungen im grafischen Überblick
Patienten mit Schubfreiheit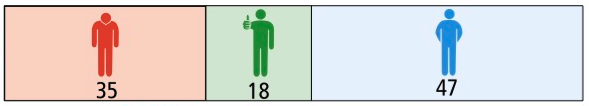
Was ist Alemtuzumab?
Alemtuzumab ist ein gentechnisch hergestellter, sogenannter „humanisierter Antikörper“, der bestimmte weiße Blutkörperchen (Leukozyten) vorübergehend aus dem Blut entfernt. Dieser Effekt hält sehr lange an.
WIe wirkt Alemtuzumab?
Alemtuzumab gehört zu den sogenannten Immuntherapien der MS.
Sie wurden unter der Vorstellung entwickelt, dass es sich bei der MS vor allem um eine Erkrankung des Immunsystems handelt. Generell zielen diese darauf ab, die Immunreaktionen teilweise zu unterdrücken. Die genaue Wirkungsweise bei MS ist nicht geklärt. Man vermutet, dass die lang anhaltende Verminderung von bestimmten weißen Blutkörperchen der Grund für die Wirksamkeit ist.
Alemtuzumab ist ein sogenannter „humanisierter monoklonaler Antikörper“. Im Blut und in Immunorganen bindet er an bestimmte weiße Blutkörperchen (vor allem sogenannte T-Lymphozyten und B-Lymphozyten und in geringem Ausmaß an Monozyten. Dadurch wird ein Anteil dieser Zellen, die für die körpereigene Abwehr, aber auch für Krankheiten wie z.B. die MS verantwortlich sind, vorübergehend zerstört. Da der Effekt mehr als ein Jahr anhält, werden vermutlich auch sogenannte Stammzellen gehemmt, also Zellen, aus denen sich neue weiße Blutkörperchen bilden. Die Rückkehr dieser Immunzellen ins Blut nach Beendigung der Therapie führt vermutlich auch zu der hohen Zahl an Nebenwirkungen durch andere Autoimmunerkrankungen, insbesondere der Schilddrüse.
Auch wenn die Effekte auf das Immunsystem lange anhalten, so ist Alemtuzumab 30 – 45 Tage nach der Infusion kaum oder nicht mehr im Blut nachweisbar.
Für wen ist Alemtuzumab zugelassen?
Die EMA (Europäische Arzneimittelargentur) hat eine Überprüfung von Alemtuzumab (Lemtrada®) eingeleitet, nachdem neue Berichte über immunvermittelte Erkrankungen, Herz/ Kreislauf-Probleme sowie Todesfälle nach der Therapie mit Alemtuzumab eingegangen sind. Während dieser Überprüfung wird die Anwendung von Alemtuzumab nur mit bestimmten Einschränkungen empfohlen.[93] Die EMA empfiehlt, dass nur noch Erwachsene, die trotz anderer krankheitsmodifizierender Therapie weiterhin an hochaktiver schubförmiger MS leiden oder Patienten mit rasch fortschreitender schubförmig-remittierend verlaufender MS Alemtuzumab anwenden sollten.[94]
Wie wird Alemtuzumab verabreicht?
Alemtuzumab wird in zwei Behandlungszyklen als intravenöse Infusion, also über eine Vene, verabreicht. Es stellt eine sogenannte Induktions- oder Impulstherapie dar:
- Zu Beginn der Behandlung erhalten Patienten an 5 aufeinanderfolgenden Tagen je eine Infusion mit 12 mg Alemtuzumab.
- Nach 12 Monaten erhalten sie an 3 aufeinanderfolgenden Tagen je eine Infusion mit 12 mg Alemtuzumab.
Wegen neuer Krankheitsaktivität wird bei einem Drittel der Patienten innerhalb von 5 Jahren eine dritte und bei 10% eine vierte Behandlungsphase mit 3 Infusionen an 3 aufeinanderfolgenden Tagen notwendig.
Wie wird die Medikamentengabe durchgeführt?
Alemtuzumab sollte nur in Zentren mit Erfahrung in der Gabe von Antikörpertherapien und mit der Möglichkeit einer sofortigen Notfallversorgung gegeben werden.
Zur Verhinderung von allergischen Nebenwirkungen sollten bei der Alemtuzumab-Gabe folgende Medikamente begleitend eingesetzt werden:
- Kortisonpräparat
- Antiallergikum
- Fiebersenkendes Medikament
- Antivirales Medikament
Während der ersten 3 Tage der Therapie wird vor der Gabe von Alemtuzumab ein Kortisonpräparat über die Vene verabreicht. Dies soll Infusionsreaktionen abmildern (siehe weiter unten im Kapitel "Welche Nebenwirkungen hat Alemtuzumab?"). Zusätzlich sollten direkt vor der Infusion weitere antiallergische Medikamente, z. B. ein Antihistaminikum und ein fiebersenkendes Medikament wie Paracetamol gegeben werden. Die Infusion selbst dauert ca. 4 Stunden, danach werden Patienten für 2 Stunden überwacht. Wenn die Infusion nicht gut vertragen wird, kann die Infusionsdauer verlängert werden.
Um Herpesinfektionen zu verhindern, sollen Patienten ab dem ersten Behandlungstag und 4 Wochen danach prophylaktisch ein antivirales Mittel (Aciclovir 2 x täglich 200 mg als Tablette) einnehmen.
Hier sehen Sie ein Foto der Medikamentenpackung (links) sowie des Infusionsfläschchens (rechts) von Lemtrada®:
Bildquelle: https://mein.sanofi.de/produkte/lemtrada
Wie wirksam ist Alemtuzumab bei schubförmiger MS?
Im Glossar finden Sie unter "Allgemeines zu Wirkungen und Nebenwirkungen von MS-Medikamenten" eine allgemeine Einführung in die Thematik, welche Ihnen helfen kann, die nachfolgenden Informationen zur Wirkung von Alemtuzumab besser zu verstehen.
Im Folgenden stellen wir die Ergebnisse für Alemtuzumab als Therapie bei Nichtansprechen einer Ersttherapie (CARE-MS II) ausführlich dar, da dies die häufigere Anwendungsform ist.
1. Wirkung auf die Schubfreiheit
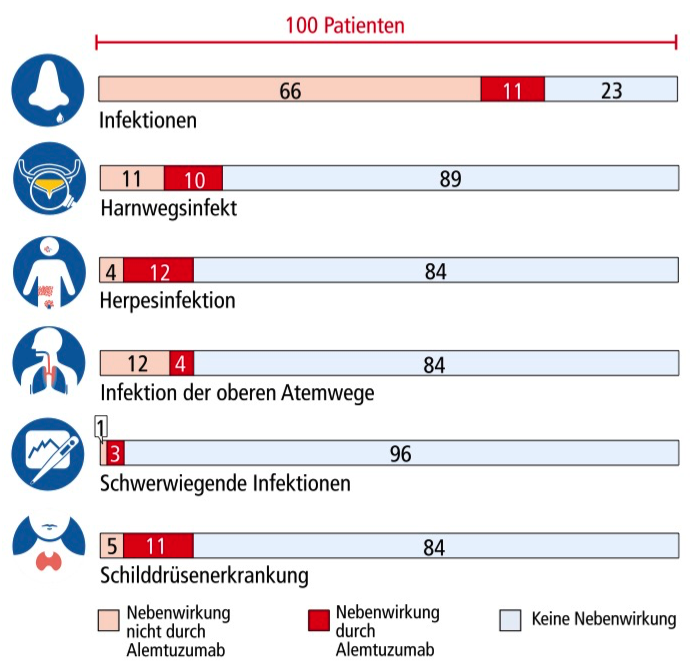
Die Grafik am Kapitelanfang zeigt, wie viele Patienten nach 2 Jahren Therapie mit Alemtuzumab oder Interferon-beta 1a noch schubfrei waren. Daraus kann man den absoluten Nutzen (absolute Risikoreduktion) und den relativen Nutzen (relative Risikoreduktion) berechnen.
Hier wird die Anzahl der Patienten mit Schüben beschrieben. Um Studienergebnisse mit unterschiedlichen Teilnehmerzahlen besser vergleichen zu können, werden die Ergebnisse bezogen auf 100 Patienten dargestellt:
Der tatsächliche Therapieeffekt zeigt sich, wenn man die Anzahl der Patienten mit Schüben in der Alemtuzumab-Gruppe (35) von denen mit Schüben in der Interferon-Gruppe (53) abzieht. Hier profitieren 53 – 35, also 18 von 100 Patienten von der Therapie.
- 18 von 100 Patienten haben einen Nutzen von der Therapie.
- 35 von 100 Patienten profitieren nicht von der Therapie, da sie trotz der Einnahme von Alemtuzumab einen Schub hatten.
- 53 von 100 Patienten profitieren nicht, da sie auch ohne Alemtuzumab schubfrei geblieben sind.
2. Wirkung auf die Anzahl der Schübe pro Jahr
Die jährliche Schubrate zeigt, wie viele Schübe durchschnittlich pro Jahr pro Patient auftraten. Sie lag in der Rebif®-Gruppe bei 0,52 Schüben gegenüber 0,26 in der Alemtuzumab-Gruppe. Etwas verständlicher ausgedrückt: Die Patienten in der Rebif®-Gruppe haben im Durchschnitt alle zwei Jahre einen Schub, die Patienten in der Fumarat-Gruppe nur alle vier Jahre.
3. Wirkung auf die Zunahme der Behinderung
Die Zunahme der Behinderung in zwei Jahren wurde in den oben beschriebenen Zulassungsstudien mithilfe des EDSS gemessen. Die Grafik am Kapitelanfang zeigt, wie viele Patienten nach einer zweijährigen Therapie mit Alemtuzumab bzw. zweijähriger Einnahme von Interferon-beta 1a keine Zunahme der Behinderung hatten. Dargestellt ist wieder der absolute Nutzen (absolute Risikoreduktion).
Im Glossar sind auch einige Angaben zum Nutzen von Medikamenten bei anderen Erkrankungen zu finden, damit Sie einen Eindruck bekommen, wie groß die Therapieeffekte bei MS im Vergleich zu anderen Therapien sind.
Im Folgenden wird die Entwicklung der Behinderung in zwei Jahren beschrieben, jeweils bezogen auf 100 Patienten:
- 13 von 100 Patienten haben trotz der Alemtuzumab-Therapie eine Zunahme der Behinderung.
- 87 von 100 Patienten profitieren nicht von der Therapie, sie haben unabhängig von der Therapie keine Zunahme der Behinderung.
- 7 von 100 Patienten haben durch die Einnahme von Alemtuzumab keine Zunahme der Behinderung.
Der tatsächliche Therapieeffekt zeigt sich, wenn man die Anzahl von Patienten mit einer Behinderungszunahme unter Alemtuzumab (15) von denen mit Rebif® (22) abzieht. Hier profitieren 20 – 13, also 7 von 100 Patienten von der Therapie.
Wirkung auf die MRT/das Kernspin in zwei Jahren
In der MRT treten Kontrastmittelanreicherungen und sogenannte T2-Herde auf, die als Ausdruck der Entzündung bei MS betrachtet werden. Dabei können Herde größer werden oder ganz neu auftreten.
Über die Studiendauer waren 32% der Patienten mit Interferon-beta 1a und 54% der Patienten mit Alemtuzumab frei von neuen oder vergrößerten T2-Herden.
Unter Alemtuzumab hatten 9% gegenüber 23% unter Rebif® im Verlauf der Studie neue Kontrastmittel aufnehmende Entzündungsherde.
Da Kontrastmittelanreicherungen nur eine Momentaufnahme sind, stellen wir nur die Entwicklung der T2-Herde im Querschnitt eines Gehirns grafisch dar. Dargestellt ist die Anzahl von 100 Patienten ohne bzw. mit neuen oder vergrößerten Herden.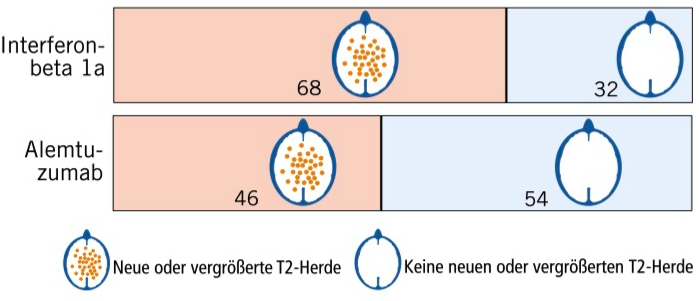
Schrumpfung des Gehirns (Hirnatrophie)
Die Hirnatrophie war in der Alemtuzumab-Gruppe mit -0,61% geringer als mit -0,81% in der Rebif®-Gruppe.
Im Glossar finden Sie Daten zu dem Anteil der Patienten, bei denen es über 2 Jahre keine Anzeichen einer Krankheitsaktivität gab (NEDA - no evidence of disease activity).
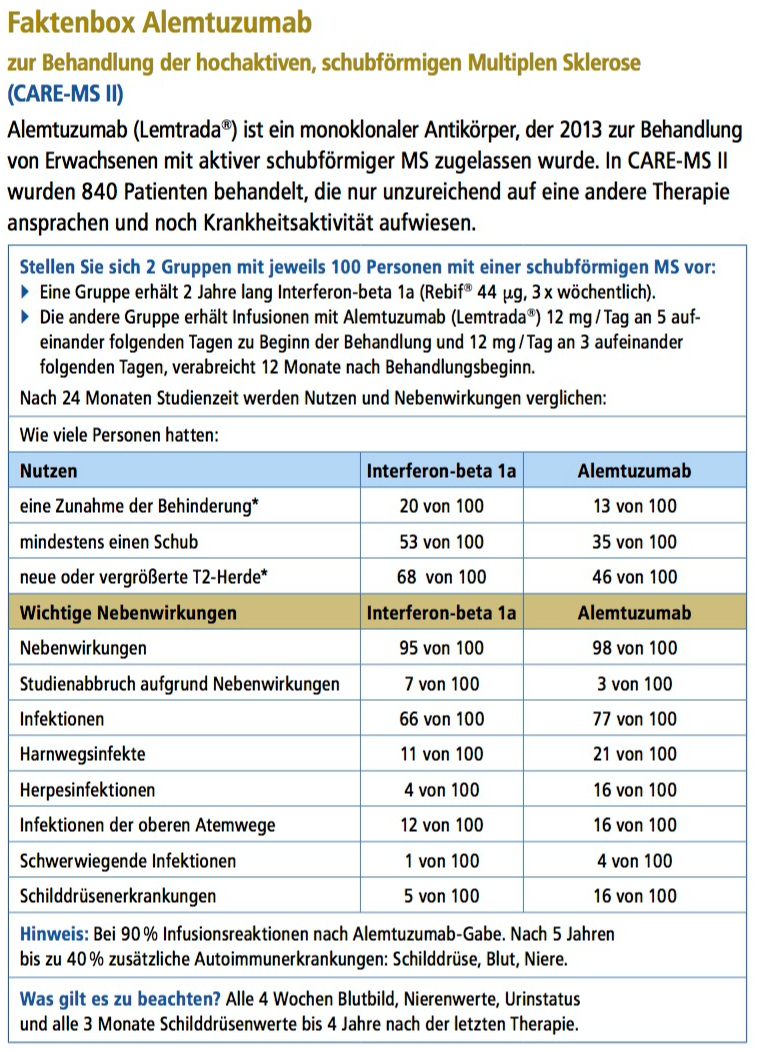
Zulassungsstudien
Zwei große, randomisiert-kontrollierte Studien haben die Wirkung von Alemtuzumab untersucht im Vergleich zu einer häufig verwendeten Immuntherapie, dem Interferon-beta 1a (Rebif® 44 μg).
1. CARE-MS I[64] (Alemtuzumab versus interferon beta 1a as first-line treatment for patients with relapsing-remitting multiple sclerosis: a randomised controlled phase 3 trial): Zulassungsstudie für bislang noch nicht behandelte Patienten.
In CARE-MS I wurden 581 Patienten mit schubförmiger MS ohne bisherige Immuntherapie in zwei Gruppen eingeteilt und entweder mit Alemtuzumab oder Rebif® 44µg über 2 Jahre behandelt. Die Patienten hatten eine mittlere Krankheitsdauer von 2 Jahren und im Mittel 1,8 Krankheitsschübe im Jahr vor Beginn der Therapie. Eingeschlossen wurden Patienten mit mindestens 2 Schüben in den letzten 2 Jahren und mindestens 1 Schub im letzten Jahr. Hier zeigt Alemtuzumab einen signifikanten Effekt auf die Häufigkeit von Schüben und das Aufhalten einer Zunahme der Beeinträchtigung im Vergleich zu Rebif® 44µg.
2. CARE-MS II[65] In CARE-MS II wurden 840 Patienten mit schubförmiger MS behandelt und über zwei Jahre beobachtet, die trotz Immuntherapie noch Krankheitsaktivität hatten, d.h. 2 Schübe in den letzten 2 Jahren. 436 Patienten erhielten 12 mg Alemtuzumab und 231 erhielten Interferon-beta 1aRebif® 44 µg. Die anderen 173 Patienten erhielten 24 mg Alemtuzumab, aber diese Behandlung wurde in der Studie abgebrochen, um die Studie schneller zu beenden. Dies ist die erste Studie, die eine bei Versagen einer untersucht hat. Das heißt, in CARE MS-II wurde erstmalig eine Therapie an Patienten getestet, bei denen eine andere MS-Therapie nicht ausreichend gewirkt hatte.
Um sicherzustellen, dass nicht allein der Glaube an ein neues, womöglich wirksameres Medikament zu einer Verbesserung der Beschwerden führt (Placeboeffekt), muss es in Studien immer eine Gruppe Patienten geben, die glaubt, dass sie das Studienmedikament erhält, obwohl das nicht der Fall ist und sie in Wirklichkeit ein Scheinmedikament (Placebo) erhalten. In CARE-MS I und CARE-MS II wussten die Patienten aber, ob sie das neue Medikament oder Interferon-beta 1a erhielten. Das führte möglicherweise auch mit zu der hohen Abbruchrate in CARE-MS II von 32%. Durch diese methodische Schwäche könnte der Nutzen von Alemtuzumab überschätzt sein.
In beiden Studien, CARE-MS I und CARE-MS II, zeigte Alemtuzumab, verglichen mit einer Therapie mit Interferon-beta 1a, eine signifikant bessere Wirksamkeit.
Da Alemtuzumab in der Realität selten als erste Therapie eingesetzt wird, stellen wir im Folgenden die Ergebnisse für Alemtuzumab als Therapie bei Nichtansprechen einer Ersttherapie (CARE-MS II) ausführlich dar, weil dies die häufigere Anwendungsform ist. Die Ergebnisse der Studie CARE-MS I finden Sie weiter unten im Kapitel „Häufig gestellte Fragen“.
Welche Nebenwirkungen hat Alemtuzumab?
Bei wie vielen Patienten traten Nebenwirkungen auf?
In CARE-MS II[65] hatten 428 (98%) der Patienten in der Alemtuzumab-Gruppe mindestens eine Nebenwirkung und 191 (95%) der Patienten
in der Interferon-beta 1a-Gruppe. Dieser Unterschied war statistisch signifikant.
Bei wie vielen Patienten führten die Nebenwirkungen zum Therapieabbruch?
Bei 15 (7%) Patienten in der Interferon-beta 1a-Gruppe und bei 14 (3%) in der Alemtuzumab-Gruppe führten die Nebenwirkungen zum Abbruch der Behandlung. Auch dieser Unterschied war statistisch signifikant.
Häufige Nebenwirkungen
Die Nebenwirkungen, die bei den Patienten der CARE-MS II Studie auftraten, lassen sich in drei Kategorien einteilen:
- Infusionsreaktionen
- Infektionen und
- sekundäre Autoimmunerkrankungen.
Hierbei ist zu beachten, dass Infusionsreaktionen ausschließlich in der Alemtuzumab-Gruppe auftraten, da die Patienten der Interferon-beta 1a-Gruppe keine Infusionen, sondern Injektionen erhielten. Da für diese Nebenwirkungen keine Vergleichsgruppe vorliegt, werden sie getrennt dargestellt.
Grundsätzlich ist wichtig zu wissen, dass Nebenwirkungen in Studien nicht nur bei den Patienten auftreten, die ein neues Medikament erhalten, sondern auch in der Studiengruppe mit einem bekannten Medikament oder Placebo.
In der Tabelle sind Nebenwirkungen aufgeführt, die aus der Studie CARE-MS II berichtet wurden und bei mindestens 2% der Patienten auftraten. Angegeben ist die Patientenzahl von 100 Patienten. In der Grafik zu Anfang des Kapitels sowie in der Faktenbox weiter unten werden jedoch lediglich die wichtigsten Nebenwirkungen dargestellt.
Die blau-weiße Tabelle zeigt die Beschwerden, die in der Alemtuzumab-Gruppe häufiger auftraten als in der Interferon-Gruppe. Darunter zeigt die grün-weiße Tabelle die Beschwerden, die in der Interferon-Gruppe häufiger auftraten als in der Alemtuzumab-Gruppe.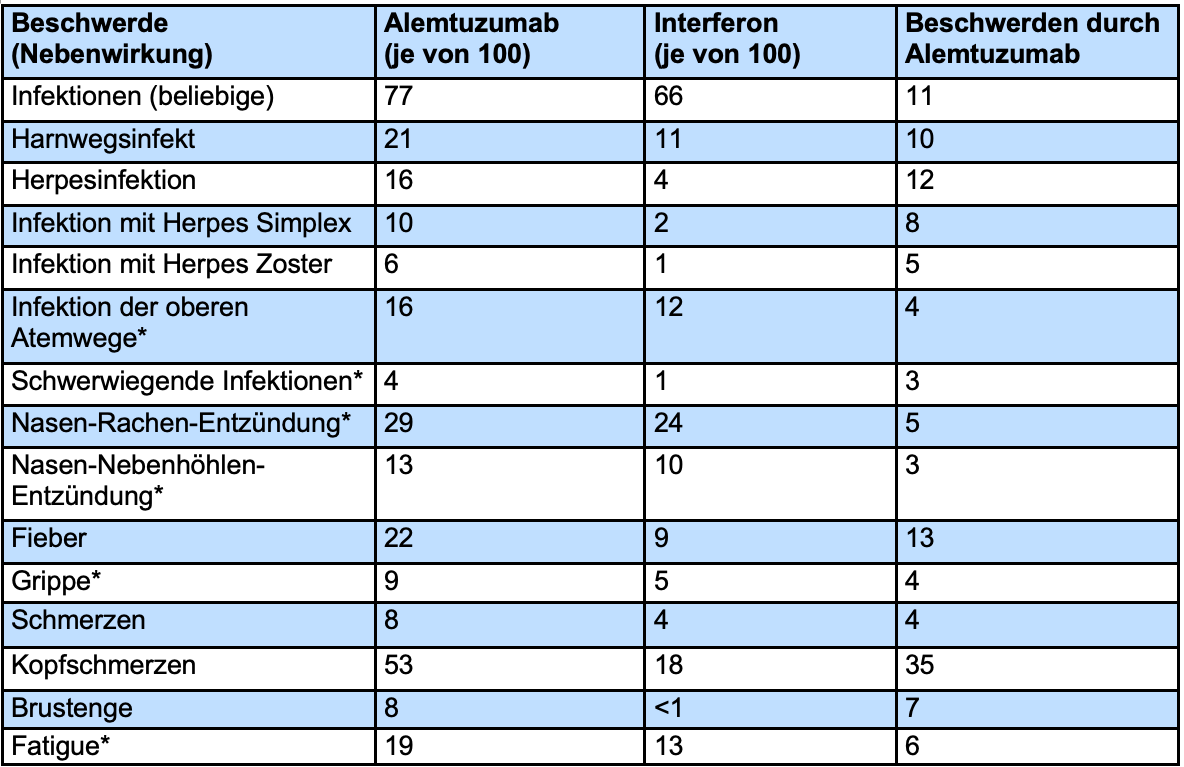
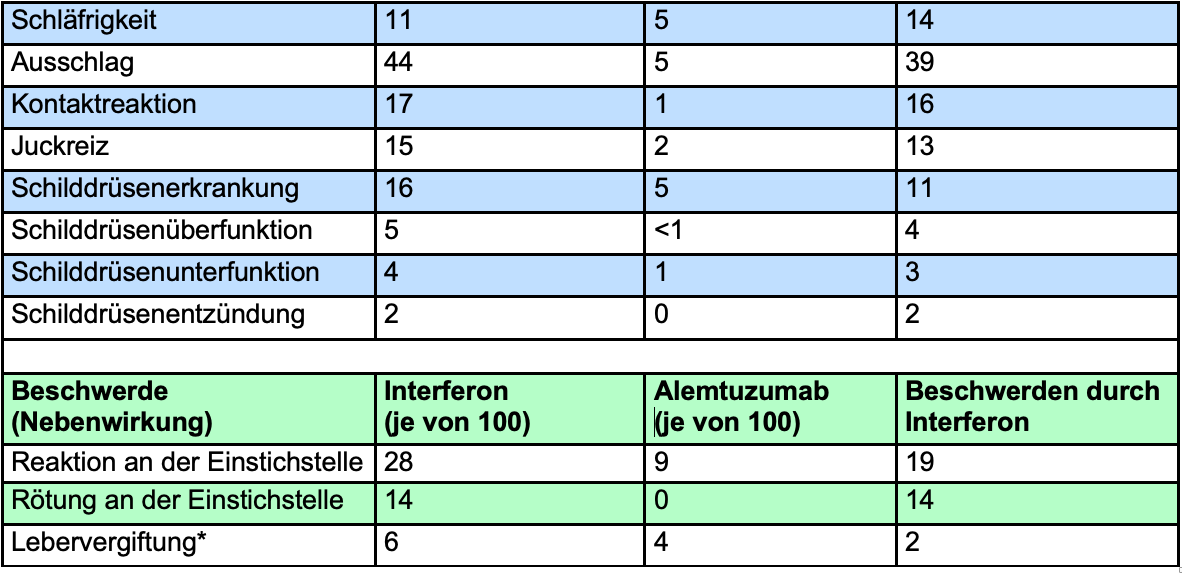
*Bei diesen Nebenwirkungen war der Unterschied zwischen der Alemtuzumab- und der Interferon-Gruppe nicht statistisch signifikant.
Auch Lungenentzündungen (1 von 100), Schmerzen (4 von 100), Brustenge (7 von 100) und Schläfrigkeit (6 von 100) wurden signifikant häufiger von Alemtuzumab-Patienten berichtet (Unterschied in der Nebenwirkungshäufigkeit jeweils in Klammern). Verglichen mit den oben genannten Nebenwirkungen sind sie aber seltener und der Zusammen- hang zu Alemtuzumab bei Schmerzen und Schläfrigkeit ist unklar.
Einstichreaktionen
Einstichreaktionen gab es nur unter Interferon-beta 1a bei 14% der Patienten.
Infusionsreaktionen
Infusionsreaktionen sind definiert als Nebenwirkungen, die innerhalb
von 24 Stunden nach Beginn der Infusion auftreten. Bei 90% der in der CARE-MS II Studie mit Alemtuzumab behandelten Patienten traten Infusionsreaktionen auf. Sie waren überwiegend mild bis moderat, bei 3% der Patienten zeigten sich schwere Infusionsreaktionen. Kein Patient brach die Behandlung mit Alemtuzumab aufgrund von Infusionsreaktionen ab. In der Verlängerung der CARE-MS II-Studie gab es zudem nach der 3. Gabe Alemtuzumab bei einem Patienten einen allergischen Schock (Verlinkung), von dem er sich ohne Folge erholte.
Im Einzelnen kamen folgende Infusionsreaktionen vor:
- Kopfschmerzen bei 43%
- Hautausschlag bei 39%
- Übelkeit bei 17%
- Fieber bei 16%
- Juckreiz bei 11%
- Schlafstörungen bei 10%
In einer zusammenfassenden Analyse von CARE-MS I[64] und CARE-MS II[65] zeigte sich, dass die Infusionsreaktionen über die Zeit weniger wurden: Traten sie bei der ersten Gabe bei 85% der Patienten auf, so waren nach der 5. Gabe noch 46% der Patienten betroffen.
Da vor der Infusion ein Kortisonpräparat verabreicht wurde, das eine Infusionsreaktion abmildern soll, könnte die Rate dieser Nebenwirkung ohne eine vorbeugende Behandlung noch höher sein.
Infektionen
Infektionen traten häufiger nach der Verabreichung von Alemtuzumab
(77% der Patienten) als bei Interferon-beta 1a (66% der Patienten) auf und verliefen meist mild bis moderat. Meist handelte es sich um Erkältungen, Infekte der oberen Atemwege und Harnwegsinfekte. Herpesinfektionen [Herpes Simplex (Lippe) und Herpes Zoster (Gürtelrose)] traten in der Alemtuzumab-Gruppe (16 von 100) häufiger auf als in der Interferon-beta 1a-Gruppe (4 von 100). Durch die prophylaktische Gabe von Aciclovir während und nach der Infusion von Alemtuzumab konnte die Häufigkeit von Herpesinfektionen deutlich gesenkt werden.
Schwere Infektionen traten in der Alemtuzumab-Gruppe bei 16 Patienten (4%) auf, in der Interferon-beta 1a-Gruppe bei 3 Patienten (1%). Ein Patient verstarb an einer Lungenentzündung (Pneumonie).
Sekundäre Autoimmunerkrankungen
Alemtuzumab kann, obwohl es gegen die Autoimmunerkrankung MS eingesetzt wird, selbst Autoimmunerkrankungen auslösen. Diese Erkrankungen sind vor allem:
1. Schilddrüsenerkrankungen
2. Gerinnungsstörungen
3. Nierenerkrankungen
Worauf muss bei der Therapie mit Alemtuzumab geachtet werden?
Unter welchen Umständen sollte Alemtuzumab nicht eingenommen werden?
Alemtuzumab darf bei einer HIV-Infektion, bei schweren chronischen Infekten wie Tuberkulose oder Hepatitis sowie in der Schwangerschaft und Stillzeit nicht verabreicht werden.
Unter folgenden Bedingungen sollte Alemtuzumab nur in Ausnahmefällen gegeben werden:
- bei bekannter Gerinnungsstörung
- bei bekannter Neigung zu Infekten
- bei anderen nicht kontrollierten Autoimmunerkrankungen
- bei bestehender Autoimmunerkrankung nur nach Risikoabwägung
- bei nicht ausgeheilten Krebserkrankungen
- bei erniedrigter Blutplättchenzahl
- ohne vorhandenen Windpockenschutz
- bei schwerer Leber- oder Nierenerkrankung
- bei Kindern unter 18 Jahren
Welche Sicherheitsabstände müssen eingehalten werden?
Bei Patienten, die bereits eine Therapie erhalten haben, die das Immunsystem beeinflusst oder hemmt, müssen Sicherheitsabstände vor Umstellung auf Alemtuzumab eingehalten werden. Diese richten sich nach der Wirkdauer der Medikamente. Die Wartezeit beträgt nach der Behandlung mit...
- Fingolimod und Teriflunomid (nach Auswaschung) mindestens 4 Wochen.
- Natalizumab und Daclizumab mindestens 6 – 8 Wochen.
- Azathioprin, Ciclosporin A, Cyclophosphamid, Methotrexat
und Mitoxantron mindestens 3 Monate.
- Cladribin mindestens 6 Monate.
- Ocrelizumab und Rituximab mindestens 6 – 12 Monate.
Bei der vorherigen Verwendung von Interferonen, Glatirameracetat oder Dimethylfumarat müssen, solange sich etwaige Blutbildveränderungen normalisiert haben, keine Sicherheitsabstände eingehalten werden.
Worauf ist bei Therapiebeginn zu achten?
Weil Alemtuzumab das Immunsystem deutlich hemmt, sollten mindestens 6 Wochen vor Therapiebeginn alle Standardimpfungen durchgeführt werden, die die STIKO (Ständige Impfkommission) für Menschen empfiehlt, deren Immunsystem teilweise blockiert werden soll. Hierzu gehört auch eine Impfung gegen Windpocken, falls diese bis dahin nicht aufgetreten sind oder der Antikörperschutz im Blut nicht ausreicht.
Bei Patienten, die bereits eine Therapie erhalten haben, die das Immunsystem beeinflusst oder hemmt, müssen Sicherheitsabstände eingehalten werden. Diese richten sich nach der Wirkdauer der Medikamente. Eine Kurzzeitbehandlung mit Kortikosteroiden (Kortison), z. B. zur Schubtherapie, ist auch während der Behandlung möglich.
Was muss während der Therapie kontrolliert werden?
Das Krankheitsbezogene Kompetenznetz Multiple Sklerose (KKNMS) empfiehlt: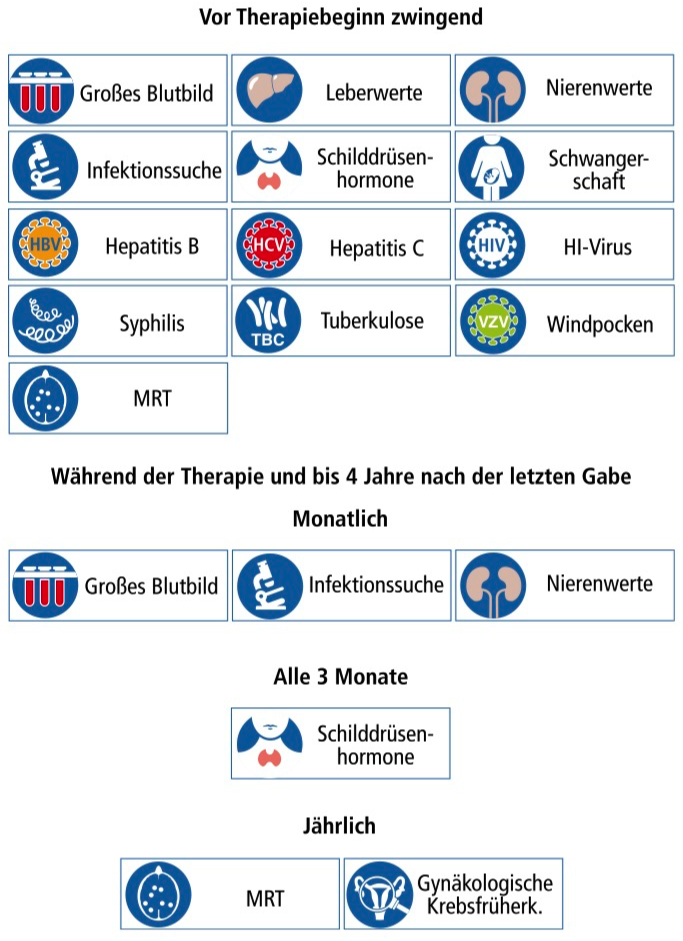
Alemtuzumab hat eine sehr lange Wirkung. Zur Frühdiagnose von Komplikationen sind daher die Nachkontrollen über insgesamt vier Jahre nach der letzten Infusion erforderlich.
Wie kann man wichtige Nebenwirkungen erkennen?
Nebenwirkungen, die während, direkt oder auch lange nach der Alemtuzumab-Gabe auftreten können, lassen sich möglicherweise früh erkennen. Dafür gibt es einige Hinweise. Die Zulassung von Alemtuzumab wurde mit der Bereitstellung von Schulungsmaterialien für Ärzte und Patienten verbunden.
Alle Patienten sollen vom behandelnden Arzt das behördlich genehmigte Schulungsmaterial im Rahmen eines so genannten Risk Management Plans (RMP) erhalten. Der RMP ist ein von den Aufsichtsbehörden (z. B. Paul-Ehrlich-Institut) herausgegebenes Schulungsmaterial, das Patienten und Ärzten für die sichere Anwendung eines Medikaments bereitgestellt wird. Der Überwachungsplan sieht monatliche bzw. dreimonatliche Untersuchungen bis zu 48 Monate nach der letzten Infusion mit Alemtuzumab vor. Eine deutsche Version des Schulungsmaterials finden Sie auf www.pei.de (> Vigilanz > Schulungsmaterial).
- Infusionsreaktionen
Infusionsreaktionen sind nicht-allergische Reaktionen, die sich in Form von Rötungen, Überwärmung, Juckreiz oder Brennen an der Infusionsstelle und/oder Kopfschmerzen, Schwindel, Benommenheit, Übelkeit oder Gelenkschmerzen äußern können. Oft hilft es in solchen Fällen, die Infusionsgeschwindigkeit zu verlangsamen und ein Medikament zur Beschwerdelinderung (z. B. Paracetamol) zu geben. Ebenfalls nicht-allergisch bedingt ist das sogenannte akute Zytokinfreisetzungssyndrom, das durch die plötzliche Freisetzung bestimmter körpereigener Botenstoffe des Immunsystems hervorgerufen wird. Typisch hierfür sind Kopfschmerzen, Fieber, Übelkeit, Juckreiz, Schlaflosigkeit, Schüttelfrost, Hitzegefühl, Ermüdung, Atembeklemmungen, Beklemmungen in der Brust, Geschmacksstörungen, Ausschlag, schneller Herzschlag, Magendrücken, Schwindelgefühl und Schmerzen. Im Einzelfall kann eine solche Reaktion nicht immer von einer allergischen Reaktion unterschieden werden. - Allergische Reaktionen
Bei allergischen Reaktionen handelt es sich um eine Abwehrreaktion des eigenen Immunsystems gegen Alemtuzumab, die bei bis zu 3% der Patienten auftritt. Es gibt unterschiedliche Schweregrade. Typische Beschwerden sind ein an weiten Teilen des Körpers einsetzender Juckreiz, Hautrötungen oder Schwellungen mit oder ohne Blasenbildung, Nasenlaufen oder Heiserkeit. In wenigen Einzelfällen, genaue Zahlen liegen nicht vor, kann ein allergischer Schock mit Herzrhythmusstörungen, Atemnot, Bauchkrämpfen inkl. Erbrechen und Durchfall sowie Blutdruckabfall mit lebensbedrohlichem Atem- und Kreislaufstillstand auftreten. - Sekundäre Autoimmunerkrankungen
Bei etwa einem Drittel der Patienten treten in den 4 Jahren nach der Behandlung mit Alemtuzumab andere Autoimmunerkrankungen auf, die therapierbar sind und häufig eine dauerhafte Behandlung erfordern. Wichtig ist, dass Sie und am besten auch die Menschen, mit denen Sie zusammenleben, die Anzeichen für diese Erkrankungen kennen, damit Sie frühzeitig einen Arzt aufsuchen können. Hier werden dann alle notwendigen Schritte zur frühen Behandlung eingeleitet – ein verzögerter Beginn erhöht das Risiko für Komplikationen.
Diese Erkrankungen sind:
- Schilddrüsenerkrankungen
- Gerinnungserkrankungen: Immunthrombozytopenische Purpura (ITP)
- Nierenerkrankungen: Glomerulonephritis (Nierenkörperchenentzündung)
Alemtuzumab - Häufig gestellte Fragen
Wirkt Alemtuzumab besser oder schlechter als andere MS-Medikamente?
Vergleich mit Beta-Interferonen:
Sowohl CARE-MS I[64] als auch CARE-MS II[65] geben Hinweise, dass Alemtuzumab Rebif® überlegen ist. Dies gilt v.a. für das Auftreten von Schüben und Verbesserungen im Kernspin. Bei der Basistherapie zeigte sich im Vergleich zu Rebif® keine überlegene Wirkung auf die Zunahme der Behinderung (3 von 100 mit zusätzlichem Nutzen). Bei der Eskalationstherapie war dieser Effekt mit 7 von 100 Patienten mit zusätzlichem Nutzen durch Alemtuzumab etwas deutlicher.
Vergleich mit Tysabri®, Gilenya®, anderen Beta-Interferonen, Tecfidera®, Copaxone®, Aubagio®:
Hierzu liegen keine Daten vor.
Wie lange wird behandelt?
Alemtuzumab wird normalerweise als Therapie mit 2 Zyklen über 2 Jahre verabreicht. Eine zusätzliche Gabe im dritten und vierten Jahr ist aber möglich. Nutzen und Risiko der Einnahme müssen laufend überprüft werden. Ein Abschätzen des Nutzens ist oft frühestens nach einem Jahr möglich. Als Hinweise für eine Wirksamkeit werden allgemeine Schubfreiheit und das Fehlen neuer Herde in der MRT angesehen.
Deshalb empfiehlt das KKNMS eine Ausgangs-MRT und anschließend jährlich eine MRT, um Nutzen und auch mögliche Risiken abzuschätzen.
In den Langzeitdaten zeigt sich, dass 36% der Patienten aus CARE-MS I[64] und 45% der Patienten aus CARE-MS II nach der zweiten Behandlung noch weitere Alemtuzumab-Gaben oder auch andere Immuntherapien erhielten, meist weil Schübe auftraten.
Schwangerschaft und Stillzeit
Alemtuzumab sollte in Schwangerschaft und Stillzeit nicht verabreicht werden. Frauen, die eine Schwangerschaft planen, sollten möglichst die 2. Behandlungsphase beendet haben und danach eine Wartezeit von 4 Monaten nach der letzten Infusion einhalten. Eine Schilddrüsenerkrankung stellt in der Schwangerschaft ein besonderes Risiko dar. Deshalb muss die Schilddrüsenfunktion bei Alemtuzumab-Patienteninnen, die schwanger werden, genau verfolgt werden.
Diese Empfehlungen sind als Vorsichtsmaßnahme zu werten, eine schädigende Wirkung auf den Embryo ist bislang nicht bekannt. Bis April 2017 sind 248 Schwangerschaften und 147 Geburten berichtet worden, die im Mittel 3 Jahre nach der Einnahme von Alemtuzumab auftraten. Bei keinem Kind wurden Missbildungen berichtet. Die Fehlgeburtsrate entsprach der Normalbevölkerung. Eine Schwangerschaft sollte während der Gabe von Alemtuzumab möglichst nicht auftreten, erscheint jedoch 4 Monate danach unproblematisch.
Wahrscheinlich geht Alemtuzumab in die Muttermilch über und sollte in der Stillzeit deshalb nicht gegeben werden.
Impfungen
Bisher sind keine negativen Effekte auf Impferfolge bekannt. Genauere Daten liegen jedoch nicht vor. Sogenannte Lebendimpfstoffe, bei denen lebendige, aber unschädlich gemachte Erreger verwendet werden, müssen möglichst vermieden werden. Alemtuzumab-Patienten haben möglicherweise keine ausreichende Abwehr und könnten durch die eigentlich harmlosen Impferreger krank werden.
Was ergab die Studie CARE-MS I[64]?
Wirkung und Nebenwirkungen von Alemtuzumab als Therapie für Patienten ohne Vorbehandlung:
In CARE-MS I wurden 581 Patienten mit schubförmiger MS ohne bisherige Immuntherapie über 2 Jahre behandelt. Die Patienten hatten eine mittlere Krankheitsdauer von 2 Jahren und im Mittel 1,8 Krankheitsschübe im Jahr vor Beginn der Therapie. An der Studie teilnehmen konnten Patienten mit mindestens einem Krankheitsschub im Jahr vor der Studie und mindestens 2 Krankheitsschüben in den letzten 2 Jahren. Die Behandlung mit Alemtuzumab zeigte einen signifikanten Effekt auf die Häufigkeit von Schüben verglichen mit Interferon-beta 1a. Weiterhin wurde auch die Zunahme der Behinderung durch eine Alemtuzumab-Therapie – im Vergleich zur Interferon-beta 1a-Therapie – aufgehalten.
Wirkung auf die Schubfreiheit
Im Verlauf der 2-jährigen CARE-MS I-Studie erlitten 41% der Patienten in der Interferon-beta 1a-Gruppe und 22% der Patienten in der Alemtuzumab-Gruppe Krankheitsschübe. Zur Veranschaulichung werden die prozentualen Ergebnisse im Folgenden auf je 100 Patienten bezogen.
Absoluter Nutzen: Der tatsächliche Therapieeffekt zeigt sich, wenn man die Anzahl der Patienten mit Schüben bei Alemtuzumab-Gabe (22) von denen mit Schüben bei Interferon-beta 1a-Gabe (41) abzieht. Tatsächlich profitieren 41 - 22, also 19 von 100 Patienten von der Therapie. Das entspricht dem absoluten Nutzen (oder auch der absoluten Risikoreduktion).
Relativer Nutzen: Man kann die Wirkung aber auch nur bezogen auf die Patienten mit Schüben darstellen. In der Interferon-beta 1a-Gruppe haben 41 Patienten einen Schub, in der Alemtuzumab-Gruppe sind es nur 22, also 19 weniger. 19 von 41 sind in Prozent umgerechnet 46%. Das entspricht dem relativen Nutzen (oder auch der relativen Risikoreduktion).
Wirkung auf die Anzahl der Schübe pro Jahr
Die jährliche Schubrate zeigt, wie viele Schübe durchschnittlich pro Jahr pro Patient auftraten. Sie lag bei Interferon-beta 1a-Gabe bei 0,39 Schüben gegenüber 0,18 bei Behandlung mit Alemtuzumab. Damit ist die relative Risikoreduktion der Schubrate 55% (0,18 / 0,39 = 55%). Etwas verständlicher ausgedrückt: Die Patienten in der Alemtuzumab-Gruppe haben im Durchschnitt nur alle 5 Jahre einen Schub, die Patienten in der Interferon-beta 1a-Gruppe alle 2,5 Jahre.
Wirkung auf die Behinderung
Die Zunahme der Behinderung wurde in den Zulassungsstudien mit Hilfe des EDSS gemessen, einer Behinderungsskala von 0 bis 10 (wobei 0 keiner Behinderung entspricht). Zur Veranschaulichung werden die prozentualen Ergebnisse auf je 100 Patienten bezogen. Dabei ist wichtig zu beachten, dass der Effekt klein war und statistisch nicht signifikant.
Absoluter Nutzen: Der tatsächliche Therapieeffekt zeigt sich, wenn man die Anzahl der Patienten mit einer Behinderungszunahme bei Alemtuzumab-Gabe (8) von denen bei Interferon-beta 1a-Gabe (11) abzieht. Tatsächlich profitieren 11 - 8, also 3 von 100 Patienten von der Therapie. Das entspricht dem absoluten Nutzen (oder auch der absoluten Risikoreduktion). Dieser Effekt war statistisch nicht sicher.
Relativer Nutzen: Man kann die Wirkung aber auch nur bezogen auf die Patienten mit einer Zunahme der Behinderung darstellen. In der Interferon-beta 1a-Gruppe haben 11 Patienten eine Zunahme der Behinderung, in der Alemtuzumab-Gruppe sind es nur 8, also 3 weniger. 3 von 11 sind in Prozent umgerechnet 27%. Das entspricht dem relativen Nutzen (oder auch der relativen Risikoreduktion). Dieser Effekt war statistisch nicht sicher.
Der EDSS-Wert nahm bei Alemtuzumab wie auch bei Interferon-beta 1a über den Verlauf der CARE-MS I Studie um 0,14 Punkte ab.
Langzeitdaten
Die Patienten, die in der 2-jährigen CARE-MS I-Studie teilgenommen hatten, konnten an einer Verlängerungsstudie teilnehmen, um die langfristigen Therapieeffekte und Nebenwirkungen zu ermitteln. 95,1% der Patienten der CARE-MS I Studie begannen mit der Verlängerungsstudie. 67,3% dieser Patienten haben außer den beiden initialen Behandlungsphasen zu Beginn der Studie im Verlauf von 5 Jahren keine weiteren Behandlungsphasen mit Alemtuzumab oder Therapien mit anderen Präparaten erhalten. 82% der Patienten wiesen über 5 Jahre einen stabilen oder verbesserten EDSS auf, bei 17,8% verschlechterte sich der EDSS.
Wirkung auf die MRT in zwei Jahren
Bei Interferon-beta 1a waren 42%, bei Alemtuzumab 52% der Patienten über die Studiendauer frei von neuen oder vergrößerten T2-Herden.
NEDA – no evidence of disease activity
Betrachtete man alle möglichen Messwerte der Krankheitsaktivität, also Schübe, Fortschreiten der Behinderung, neue T2-Herde und Kontrastmittelanreicherungen, so kann man den „NEDA-Status“ bestimmen. In CARE-MS I wurde dieser bei Interferon-beta 1a in 27% und bei Alemtuzumab in 39% der Fälle erreicht.
Welche Nebenwirkungen hat Alemtuzumab laut der CARE-MS I Studie?
Die Nebenwirkungsprofile der CARE-MS I Studie und der CARE-MS II Studie sind vergleichbar. In der 2-jährigen CARE-MS I-Studie hatten 361 (96%) der Patienten in der Alemtuzumab-Gruppe mindestens eine Nebenwirkung und 172 (92%) der Patienten in der Interferon-beta 1a-Gruppe.
Bei 11 (6%) Patienten in der Interferon-beta 1a-Gruppe und bei 5 (1%) in der Alemtuzumab-Gruppe führten die Nebenwirkungen zum Abbruch der Behandlung.
Die Nebenwirkungen, die bei den Patienten der CARE-MS I Studie auftraten, lassen sich in drei Kategorien einteilen:
- Infusionsreaktionen,
- Infektionen und
- sekundäre Autoimmunerkrankungen.
Hierbei ist zu beachten, dass Infusionsreaktionen ausschließlich in der Alemtuzumab-Gruppe auftraten, da die Patienten der Interferon-beta 1a-Gruppe keine Infusionen, sondern Injektionen erhielten.
Infusionsreaktionen (infusionsassoziierte Reaktionen) sind definiert als Nebenwirkungen, die innerhalb von 24 Stunden nach Beginn der Infusion auftreten (siehe dazu weiter oben im Kapitel "Worauf muss bei der Therapie mit Alemtuzumab geachtet werden?"). Infusionsreaktionen liegen nur für Alemtuzumab vor. Diese traten bei 90% der Patienten auf. Im Einzelnen kamen dabei vor:
- Kopfschmerzen bei 43%
- Hautausschlag bei 41%
- Fieber bei 33%
- Übelkeit bei 14%
- Nesselsucht bei 11%
- Flush bei 11%
- Schüttelfrost bei 10%
Andere Nebenwirkungen
Bei 3% der Patienten zeigten sich schwere Infusionsreaktionen. Kein Patient brach die Behandlung mit Alemtuzumab aufgrund von Infusionsreaktionen ab. Auch nach über 24 Stunden können Infusionsreaktions-ähnliche Symptome auftreten.
Allergische Reaktionen im engeren Sinn mit schwerer Kreislaufstörung und Hautausschlag sind dabei nicht sicher von einer Infusionsreaktion zu trennen.
Im Folgenden ist dargestellt, wie viel häufiger, bezogen auf 100 Patienten, Nebenwirkungen in der Alemtuzumab-Gruppe verglichen mit der Interferon-beta 1a-Gruppe auftraten:
- Infektionen –> 22 von 100
- Herpesinfektionen –> 15 von 100
- Schilddrüsenfunktionsstörungen –> 12 von 100
Bei Interferon-beta 1a trat deutlich häufiger eine Leberwerterhöhung auf (17% gegenüber 4%). Auch grippeähnliche Beschwerden traten bei Interferon-beta 1a häufiger auf (30% im Vergleich zu 5% unter Alemtuzumab).
Infektionen traten häufiger nach der Verabreichung von Alemtuzumab (67% der Patienten) als bei Interferon-beta 1a (45% der Patienten) auf und verliefen meist mild bis moderat. Meist handelte es sich um Erkältungen, Harnwegsinfekte und Herpesinfektionen [Herpes Simplex (Lippe) und Herpes Zoster (Gürtelrose)]. Herpesinfektionen traten in der Alemtuzumab-Gruppe (16 von 100) häufiger auf als in der Interferon-beta 1a-Gruppe (2 von 100). Durch die vorbeugende Gabe von Aciclovir während und nach der Infusion von Alemtuzumab konnte die Häufigkeit von Herpesinfektionen deutlich gesenkt werden. Außerdem traten Infekte der oberen Atemwege auf. Schwere Infektionen traten in der Alemtuzumab-Gruppe bei 2% der Patienten auf, in der Interferon-beta 1a-Gruppe bei 1 % der Patienten.
Sekundäre Autoimmunerkrankungen
Alemtuzumab kann, obwohl es gegen die Autoimmunerkrankung MS eingesetzt wird, selbst Autoimmunerkrankungen auslösen. Diese Erkrankungen sind vor allem:
1. Schilddrüsenerkrankungen
2. Gerinnungsstörungen
3. Nierenerkrankungen
1. Schilddrüsenerkrankungen
Bei 18% der Patienten unter Alemtuzumab gegenüber 6% der Patienten mit Interferon-beta 1a trat eine Schilddrüsenerkrankung auf, meist eine Überfunktion. In den Verlängerungsstudien der CARE-MS I zeigte sich, dass Schilddrüsenerkrankungen am häufigsten im 3. Jahr nach Therapiebeginn (16,7%) auftreten und dann in der Häufigkeit abnehmen. Die schwerwiegenden Schilddrüsenereignisse traten ebenfalls im 3. Jahr nach Behandlungsbeginn mit 3,3% am häufigsten auf und nahmen dann wieder ab. Bei 1% (3 Patienten) bei Alemtuzumab war diese Erkrankung schwerwiegend, das heißt, es kam zu deutlichen Beschwerden einer Überfunktion oder einer Schilddrüsenvergrößerung. Über den Verlauf von 5 Jahren seit Therapiebeginn entwickelten 40,7% der mit Alemtuzumab behandelten Patienten eine Schilddrüsenerkrankung. Über 5 Jahre kam es bei 3,7% der Patienten zu einer Entfernung der Schilddrüse, die dann Schilddrüsenhormone als Tablette einnehmen mussten.
2. Gerinnungsstörungen (Immunthrombozytopenie, ITP)
Zu einer schweren Verminderung der Blutplättchen, die für die Blutgerinnung notwendig sind, kam es in CARE-MS I bei Alemtuzumab bei 3 Patienten, bei Interferon-beta 1a gab es keinen Fall. Diese Verminderung der Blutplättchen kann zu Hautblutungen, Schleimhautblutungen, aber auch inneren Blutungen führen. In einer Studie starb ein Patient an einer ITP. Ein weiterer Todesfall außerhalb einer Studie wurde
im November 2017 gemeldet.
3. Nierenerkrankungen
In CARE-MS I traten keine Nierenerkrankungen auf. Bislang sind insgesamt 4 Fälle einer antikörpervermittelten Nierenerkrankung unter Alemtuzumab bekannt. Alle wurden im Rahmen der regelmäßigen Laboruntersuchungen erkannt und erfolgreich behandelt.
Veränderungen von Blutwerten
Bei den Patienten der CARE-MS I und CARE-MS II Studien zeigten
sich ähnliche Veränderungen der Blutwerte. Ziel der MS-Therapie mit Alemtuzumab ist eine Reduktion der Aktivität von Entzündungszellen. Das Medikament führt zu einer vorübergehenden Reduktion eines Teils der weißen Blutzellen (Leukozyten). Zwei Untergruppen dieser Zellen, die B- und T-Lymphozyten, sind aber langanhaltend reduziert. Die Anzahl der B-Lymphozyten normalisierte sich innerhalb von 6 Monaten wieder. Die T-Lymphozyten befanden sich erst nach 12 Monaten wieder im unteren Normbereich. Auch nach der zweiten Gabe, ein Jahr später, fand sich eine ähnliche vorübergehende Reduktion der Lymphozytenzahl. Das Ausmaß der Reduktion der Lymphozyten scheint dabei kein Indikator für die Wirksamkeit zu sein.
Veränderungen von anderen Laborwerten, wie beispielsweise Leberwerten, wurden nicht beobachtet.
Schwere Nebenwirkungen und Todesfälle
Schwere Nebenwirkungen traten in CARE-MS I bei 18% der Patienten mit Alemtuzumab und bei 14% mit Interferon-beta 1a auf. Drei Patienten entwickelten eine als schwer eingestufte Immunthrombozytopenie. Diese entstanden z. T. schnell, z. T. langsam (innerhalb von 14 bis zu 36 Monaten). Nach Studienende entwickelte ein Patient, der eine dritte Alemtuzumab-Behandlung erhalten hatte, eine Antikörper- vermittelte Nierenerkrankung und wurde erfolgreich behandelt.
Eine Frau mit Schilddrüsen-Überfunktion, die in der Studie schwanger wurde, sowie ihr Kind erlitten nach der Geburt eine so genannte thyreotoxische Krise mit übermäßiger Schilddrüsenhormonausschüttung.
In CARE-MS I traten zudem bei Alemtuzumab 2 Todesfälle auf: Ein Patient verstarb bei einem Autounfall, bei einem anderen Patienten trat nach Studienende eine Verminderung aller Blutzellen auf; eine daraufhin aufgetretene schwere Infektion endete tödlich.
Krebserkrankungen
2 Patienten mit Alemtuzumab entwickelten eine Schilddrüsenkrebserkrankung.
In der Faktenbox auf der nächsten Seite sehen Sie noch einmal die wichtigsten Ergebnisse der CARE-MS I Studie auf einen Blick.