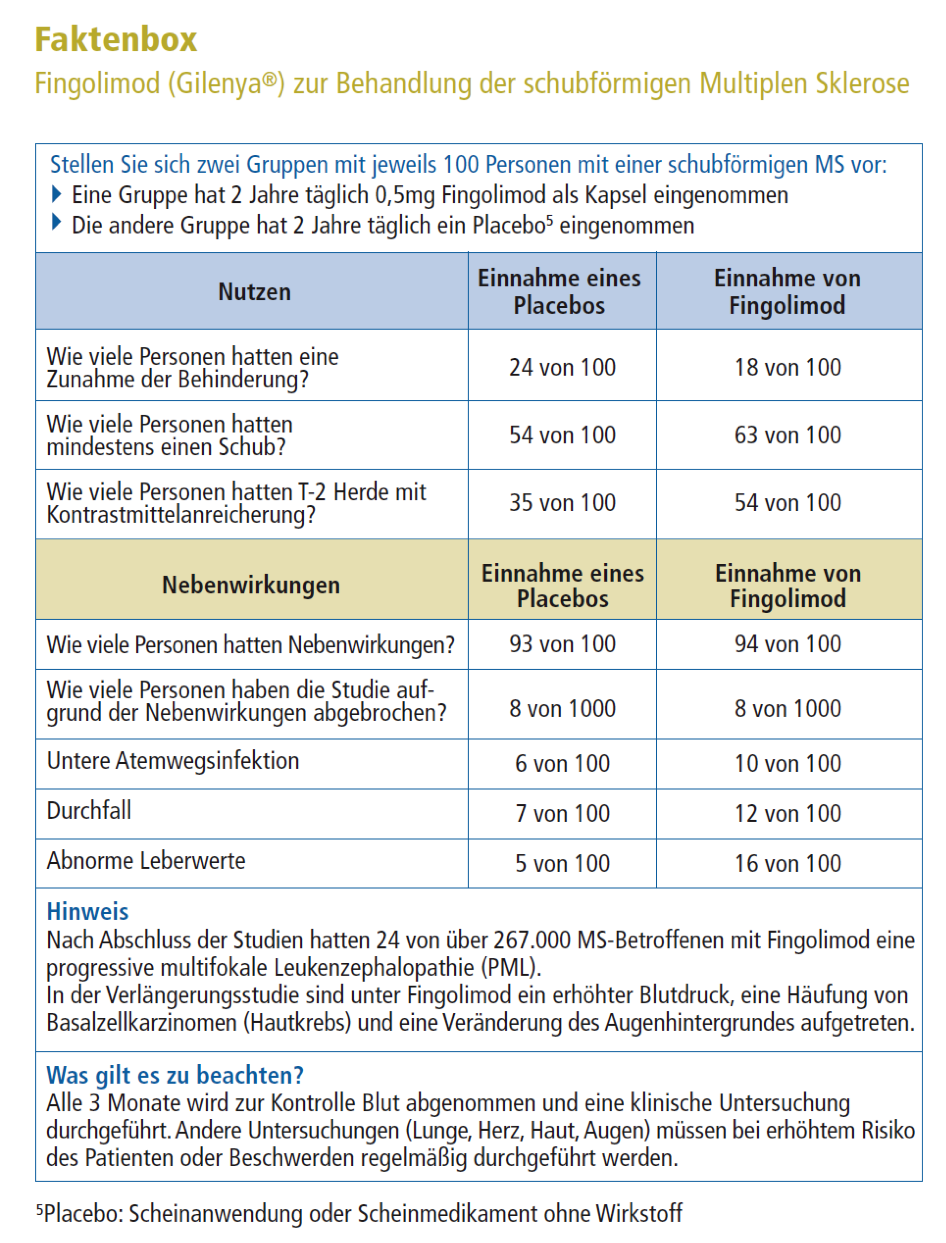
Fingolimod (Gilenya®)
Fingolimod ist in Deutschland mit 0,5mg für Erwachsene seit 2011 zugelassen. Für Kinder folgte die Zulassung 2018 für die geringere Dosierung von 0,25mg. Es wird täglich oral als Kapsel eingenommen. Bei einem Teil der Patienten reduziert Fingolimod die Schubrate und die Zunahme der Beeinträchtigung. An wichtigen Nebenwirkungen können auftreten: eine verlangsamte Herzfrequenz, schwere Infektionen, Veränderungen der Leberwerte und eine Veränderung am Augenhintergrund. Zur Überwachung müssen regelmäßige Blutuntersuchungen erfolgen und bei vorliegendem Risiko oder entsprechenden Beschwerden spezielle Untersuchungen gemacht werden. Das Medikament wird in der Apotheke unter dem Namen Gilenya® vertrieben.
Wirkungen & Nebenwirkungen im grafischen Überblick
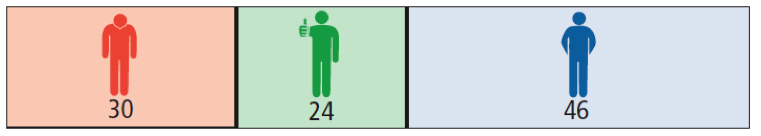

Patienten ohne Zunahme der Behinderung


Was ist Fingolimod?
Fingolimod ist eine künstlich hergestellte chemische Verbindung, die dem Myriocin ähnelt. Das ist ein Stoffwechselprodukt aus einem in der chinesischen Medizin verwendeten Pilz, das eine hemmende Wirkung auf das Immunsystem hat.
Wie wirkt Fingolimod?
Fingolimod setzt sich an die Bindungsstelle eines Oberflächenmoleküls, des sogenannten Sphingosin-1-Phosphat-Rezeptors. Dieser befindet sich in vielen verschiedenen Geweben des Körpers. Die Auswirkung auf das Immunsystem ist eine Auswanderungshemmung weißer Blutzellen: Das heißt, dass Lymphozyten daran gehindert werden, aus den Lymphknoten ins Blut überzutreten. Somit wird das Immunsystem gehemmt. Dadurch werden die Schäden, die fehlgeleitete Lymphozyten an den Markscheiden der Nervenzellen bei MS anrichten, vermindert, da weniger T-Lymphozyten in das Nervensystem gelangen.
Für wen ist Fingolimod zugelassen?
Fingolimod ist seit 2011 in Europa für Erwachsene mit schubförmig verlaufender Multiple Sklerose als Tablette zugelassen. Empfohlen wird es, „wenn Patienten auf andere Medikamente nicht ansprechen“, oder „Patienten an einer schnell fortschreitenden schweren Form der MS leiden“. Seit 2018 ist Fingolimod auch für Kinder ab 10 Jahren zugelassen.
Wie wird Fingolimod eingenommen?
Fingolimod wird einmal täglich mit einer Dosis von 0,5mg oral eingenommen. Die Kapsel kann mit oder ohne Nahrung eingenommen werden. Die zugelassene Dosis für Kinder mit einem Körpergewicht unter 40kg beträgt 0,25mg.
Fingolimod sollte unter einer einmaligen 6-Stunden-Überwachung des Herzens in einem Zentrum, das eine kardiologische Station hat, gestartet werden. Herzrhythmus, Blutdruck und Herzfrequenz sollten hier stündlich kontrolliert werden. Nach den 6 Stunden sollte erneut ein komplettes EKG gemacht werden, bevor der Patient entlassen werden kann.
Hier sehen Sie ein Foto der Medikamentenpackung und Tabletten von Gilenya®:
Bildquelle: https://www.apotheke-adhoc.de/nachrichten/detail/pharmazie/gilenya-norvatis-im-visier-der-fda/
Wie wirksam ist Fingolimod bei schubförmiger MS?
Im Glossar finden Sie unter „Allgemeines zu Wirkungen und Nebenwirkungen von MS-Medikamenten“ eine allgemeine Einführung in die Thematik, welche Ihnen helfen kann, die nachfolgenden Informationen zur Wirkung von Teriflunomid besser zu verstehen.
Die folgenden Daten stammen aus den Ergebnissen der Zulassungsstudie FREEDOMS[54] (für mehr Informationen siehe weiter oben im Kapitel „Welche Zulassungsstudien wurden für Fingolimod durchgeführt?“).
1. Wirkung auf die Schubfreiheit
Die Grafik am Kapitelanfang zeigt, wie viele Patienten nach zwei Jahren Therapie mit Fingolimod bzw. Einnahme von Placebos noch schubfrei waren. Daraus kann man den absoluten Nutzen (absolute Risikoreduktion) und den relativen Nutzen (relative Risikoreduktion) berechnen.
Hier wird die Anzahl der Patienten mit Schüben beschrieben. Um Studienergebnisse mit unterschiedlichen Teilnehmerzahlen besser vergleichen zu können, werden die Ergebnisse bezogen auf 100 Patienten dargestellt:
Der tatsächliche Therapieeffekt zeigt sich, wenn man die Anzahl von Patienten mit Schüben unter Teriflunomid (30) von denen mit Schüben unter Placebo (54) abzieht. Hier profitieren 54 – 30, also 24 von 100 Patienten von der Therapie. Das entspricht dem absoluten Nutzen (oder auch der absoluten Risikoreduktion).
- 24 von 100 Patienten haben einen Nutzen von der Therapie.
- 30 von 100 Patienten profitieren nicht von der Therapie, da sie trotz der Einnahme von Fingolimod einen Schub hatten.
- 46 von 100 Patienten profitieren nicht, da sie auch ohne Fingolimod schubfrei geblieben sind.
2. Wirkung auf die Anzahl der Schübe pro Jahr
Die jährliche Schubrate zeigt, wie viele Schübe durchschnittlich pro Jahr pro Patient auftraten. Sie lag in der Placebo-Gruppe bei 0,4 Schüben gegenüber 0,18 in der Fingolimod-Gruppe. Etwas verständlicher ausgedrückt: Die Patienten in der Placebo-Gruppe haben im Durchschnitt alle 2,5 Jahre einen Schub, die Patienten in der Fingolimod-Gruppe nur alle 5 Jahre.
3. Wirkung auf die Zunahme der Behinderung
Die Zunahme der Behinderung wurde in der oben beschriebenen Zulassungsstudie mit Hilfe des EDSS gemessen, einer Behinderungsskala von 0 bis 10 (wobei 0 keiner Behinderung entspricht). Die Grafik am Kapitelanfang zeigt, wie viele Patienten nach einer zweijährigen Therapie mit Fingolimod bzw. zweijähriger Einnahme von Placebos keine Bestätigung der Zunahme der Behinderung hatten. Dargestellt sind wieder der absolute Nutzen (absolute Risikoreduktion) und der relative Nutzen (relative Risikoreduktion).
Im Glossar finden Sie Angaben zum Nutzen von Medikamenten bei anderen Erkrankungen. So bekommen Sie einen Eindruck davon, wie groß die Therapieeffekte bei MS im Vergleich zu denen bei anderen Krankheiten sind.
Im Folgenden wird die Entwicklung der Behinderung in zwei Jahren beschrieben, jeweils bezogen auf 100 Patienten:
- 18 von 100 Patienten haben trotz der Fingolimod-Therapie eine Zunahme der Behinderung.
- 76 von 100 Patienten profitieren nicht von der Therapie, sie haben unabhängig von der Therapie keine Zunahme der Behinderung.
- 6 von 100 Patienten haben durch die Einnahme von Fingolimod keine Zunahme der Behinderung.
Der tatsächliche Therapieeffekt zeigt sich, wenn man die Anzahl von Patienten mit einer Behinderungszunahme unter Fingolimod (18) von denen mit Placebo (24) abzieht. Hier profitieren 24 - 18, also 6 von 100 Patienten von der Therapie.
4. Wirkung auf die MRT/das Kernspin in zwei Jahren
In der MRT treten Kontrastmittelanreicherungen und sogenannte T2-Herde auf, die als Ausdruck der Entzündung bei MS betrachtet werden. Dabei können Herde größer werden oder ganz neu auftreten.
21% der Patienten in der Placebo-Gruppe und 51% in der Fingolimod-Gruppe waren über die Studiendauer frei von neuen oder vergrößerten T2-Herden.
65% der Patienten in der Placebo-Gruppe und 90% in der Fingolimod-Gruppe hatten über die Studiendauer keine Herde mit Kontrastmittelanreicherungen.
Da Kontrastmittelanreicherungen nur eine Momentaufnahme sind, stellen wir nur die Entwicklung der T2-Herde im Querschnitt eines Gehirns grafisch dar. Dargestellt ist die Anzahl von 100 Patienten ohne bzw. mit neuen oder vergrößerten Herden.
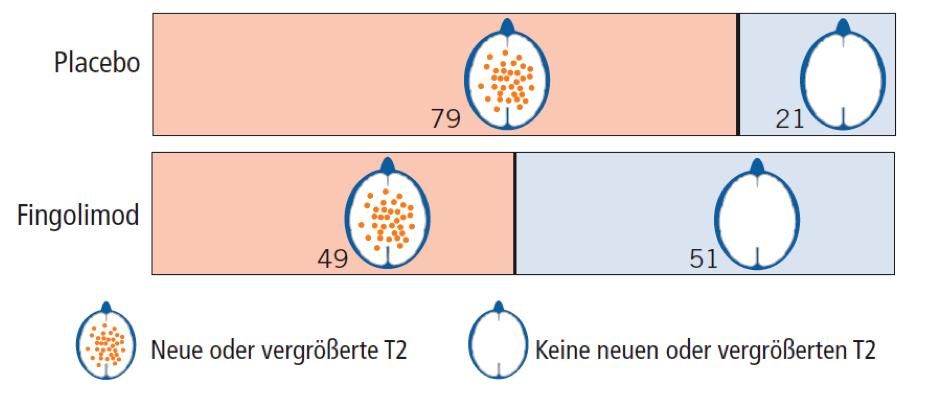
Im Glossar finden Sie Daten zu dem Anteil der Patienten, bei denen es über 2 Jahre keine Anzeichen einer Krankheitsaktivität gab (NEDA - no evidence of disease activity).
Zulassungsstudien
Die Wirkung von Fingolimod auf die Schubrate und die Zunahme der Behinderung wurde in der Zulassungsstudie FREEDOMS[54] (FTY720 Research Evaluating Effects of Daily Oral Therapy in Multiple Sclerosis) von Kappos et al. 2010 geprüft. Insgesamt wurden hier 1272 Patienten mit schubförmiger Multiplen Sklerose zwischen 18 und 55 Jahren über einen Zeitraum von 2 Jahren untersucht. Eingeschlossen wurden Patienten, die in dem Jahr vor Studienbeginn mindestens einen Schub hatten oder in den 2 Jahren vor Studienbeginn mindestens 2 Schübe. Noch dazu mussten die Patienten einen EDSS-Score zwischen 0 und 5,5 vorweisen. In der Studie wurden die Patienten zufällig in 3 Gruppen eingeteilt: Eine Gruppe bekam ein Placebo, eine Gruppe 1,25mg Fingolimod und eine Gruppe 0,5mg Fingolimod täglich.
Beobachtete Endpunkte waren die annualisierte (jährliche) Schubrate, die Zeit bis zum ersten Schub, die Zunahme der Behinderung und Nebenwirkungen.
Da nur 0,5mg Fingolimod in Deutschland zugelassen wurden, wird im Folgenden nur noch die 0,5mg-Fingolimod-Gruppe erwähnt und nur als „Fingolimod-Gruppe“ bezeichnet.
Die ursprüngliche Zulassungsstudie FREEDOMS wurde als Verlängerungsstudie nach Abschluss um weitere 2 Jahre verlängert und FREEDOMS II genannt. Sie wurde von Calabresi et. al 2014 veröffentlicht. Hier wurde 1083 (85%) derselben Patienten über weitere 2 Jahre entweder ein Placebo oder 0,5mg Fingolimod gegeben. Alle Patienten, die in der ersten Studie in der 1,25mg-Fingolimod-Gruppe waren, wurden weiter als diese Gruppe bezeichnet, bekamen in dieser Studie aber auch nur 0,5mg Fingolimod, da die höhere Dosis keinen zusätzlichen Nutzen gezeigt hatte. Endpunkte waren unter anderem die annualisierte Schubrate, die Zunahme der Behinderung und die Schubfreiheit.
Welche Nebenwirkungen hat Fingolimod?
Die folgenden Daten entstammen der oben beschriebenen Zulassungsstudie FREEDOMS[54].
Bei wie vielen Patienten traten Nebenwirkungen auf?
Laut der FREEDOMS-Studie hatten 401 von 425 (94%) der Patienten in der Fingolimod-Gruppe Nebenwirkungen und 387 von 418 (93%) der Patienten in der Placebo-Gruppe. Dieser Unterschied war statistisch nicht signifikant.
Grundsätzlich ist wichtig zu wissen, dass Nebenwirkungen in Studien nicht nur bei den Patienten auftreten, die ein neues Medikament erhalten, sondern auch in der Studiengruppe mit einem bekannten Medikament oder Placebo (siehe "Allgemeines zu Wirkungen und Nebenwirkungen von MS-Medikamenten").
Bei wie vielen Patienten führten die Nebenwirkungen zum Therapieabbruch?
In beiden Gruppen brachen je 8% der Patienten die Behandlung aufgrund von Nebenwirkungen ab.
Häufige Nebenwirkungen
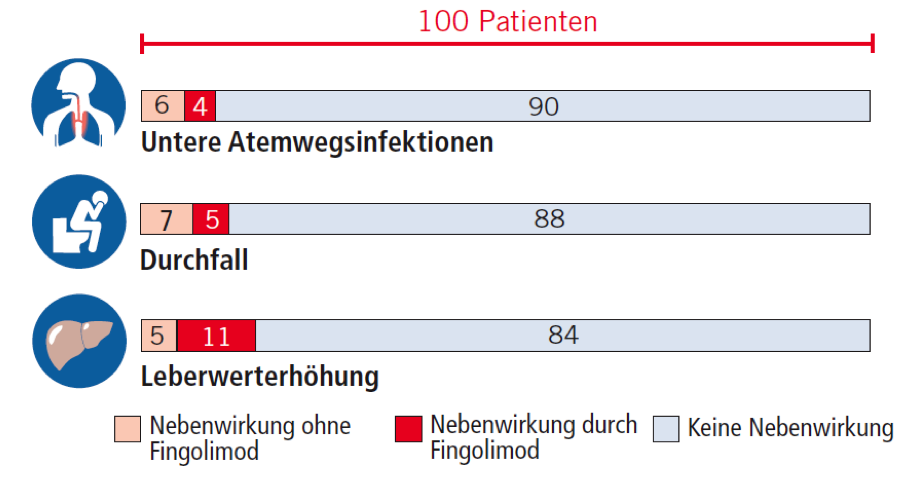
In der Tabelle sind Nebenwirkungen aufgeführt, die aus der Zulassungsstudie FREEDOMS berichtet wurden und bei mindestens 2% der Patienten auftraten. Angegeben ist die Patientenzahl von 100 Patienten.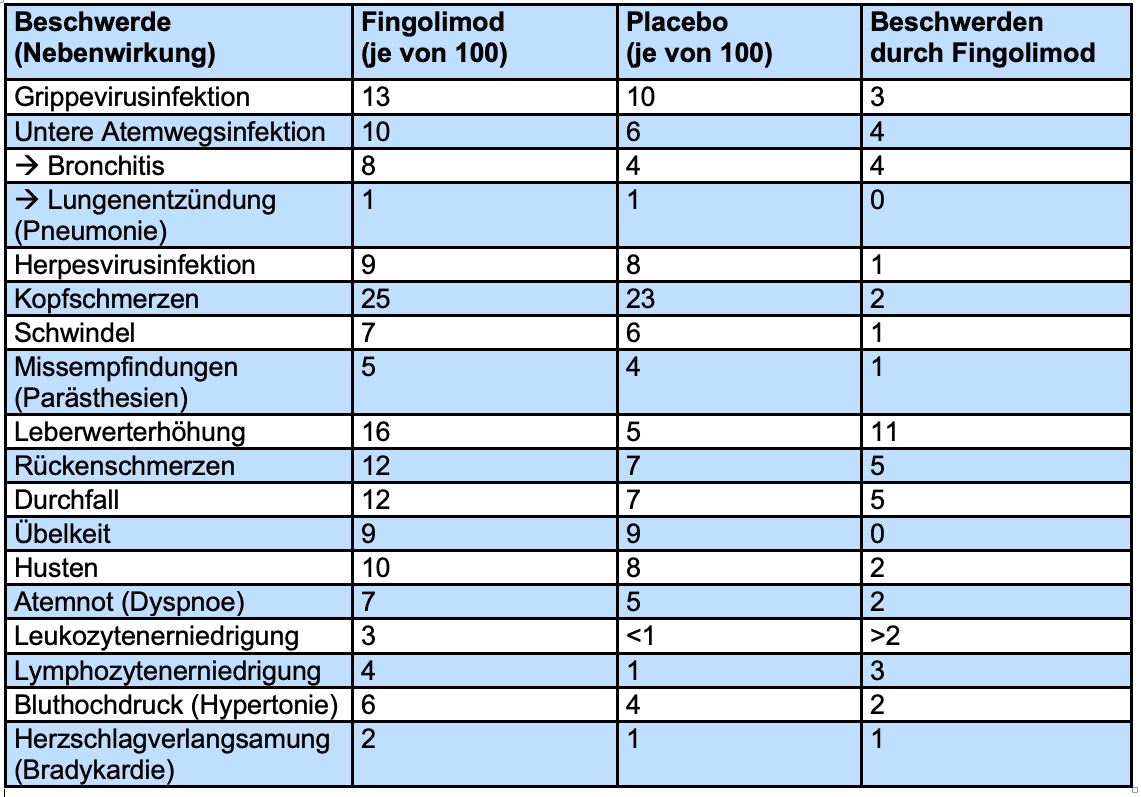
Untere Atemwegsinfektionen
Untere Atemwegsinfektionen traten signifikant häufiger auf bei Patienten, die Fingolimod nahmen, im Vergleich zu den Patienten der Placebo-Gruppe. Unter unteren Atemwegsinfektionen wurden auch Lungenentzündungen und Bronchitiden (Verlinkung) gezählt. Es gab 34 Patienten (8%) der Fingolimod-Gruppe, die über eine Bronchitis berichteten, und 15 Patienten (4%) der Placebo-Gruppe. Dieser Unterschied war signifikant.
Lungenentzündungen (Pneumonien)
Lungenentzündungen traten in der Zulassungsstudie bei 4 Patienten (1%) der Fingolimod-Gruppe und 3 Patienten (1%) der Placebo-Gruppe auf. Bei der Verlängerungsstudie FREEDOMS II (Verlinkung?) aber wurde eine signifikant erhöhte Zahl von Lungenentzündungen bei Fingolimod festgestellt mit 5 Fällen (1%) gegenüber keinem (0%) unter Placebo.
Durchfall
Genauere Informationen zur Schwere der berichteten Durchfallerkrankung liegen nicht vor. Sie trat bei 7 von 100 Patienten der Placebo-Gruppe und 12 von 100 Patienten der Fingolimod-Gruppe auf. Dieser Unterschied war signifikant.
Leberwerterhöhung
Ein häufig genutzter Leberwert, die sogenannte Alanin-Aminotransferase (auch ALT, ALAT oder GPT abgekürzt), erreichte in 9% der Fingolimod-Gruppe und 2% der Placebo-Gruppe Werte, die das Dreifache der normalen Obergrenze betrugen. Dieser Unterschied war signifikant. Bei einem Patienten der Fingolimod-Gruppe erreichten die Werte das 10-fache der Obergrenze. Bei allen Patienten normalisierten sich die Leberwerte nach einiger Zeit wieder, auch bei denen, die das Medikament trotz der Erhöhung ihrer Leberwerte nicht absetzten, sondern weiter einnahmen. Die Veränderung des Leberwertes ALT trat besonders häufig bei Männern auf.
Weitere Nebenwirkungen:
Weitere Nebenwirkungen wurden den Zulassungsstudien FREEDOMS I, FREEDOMS II, TRANSFORMS[21] und der Gilenya-Fachinformation entnommen. Wenn nicht anders beschrieben, beziehen sich die Zahlen auf die FREEDOMS I Studie.
Herzschlagverlangsamung
Eine Verlangsamung des Herzschlags (Bradykardie) trat bei 9 Patienten (2%) der Fingolimod-Gruppe und 3 Patienten (1%) der Placebo-Gruppe auf. Dieser Unterschied war nicht signifikant. Die meisten Fälle traten in den ersten 6 Stunden, nachdem das Medikament neu gegeben wurde, auf. Alle normalisierten sich innerhalb von 24 Stunden wieder. Die Verlangsamung des Herzschlags betrug im Durschnitt 12-13 Schläge pro Minute. Das sind ca. 20% eines normalen Herzrhythmus von 60-80 Schlägen pro Minute. Bei regelmäßiger Einnahme ging die durchschnittliche Herzfrequenz innerhalb eines Monats wieder auf den Ausgangswert zurück.
Bluthochdruck (Hypertonie)
In der Verlängerungsstudie FREEDOMS II (Verlinkung/siehe Kapitel ... weiter oben) wurden bei 3% der Placebo-Patienten und 9% der Fingolimod-Patienten Blutdruckerhöhungen beobachtet. Es gab einen sehr geringen Anstieg des Blutdrucks (Verlinkung?) bei allen Patienten, der sich ca. einen Monat nach Therapiebeginn zeigte und während der Behandlung bestehen blieb.
Augenhintergrundveränderungen
Eine Veränderung des Augenhintergrunds mit Wassereinlagerung an der Stelle des schärfsten Sehens (auch Makulaödem) genannt, kam in der Zulassungsstudie in 7 Fällen vor. Alle davon waren in der Gruppe, die die in Deutschland nicht zugelassene Dosis 1,25 mg Fingolimod erhielten. 6 dieser Fälle normalisierten sich 1 bis 6 Monate, nachdem die Therapie abgebrochen wurde. In der Verlängerungsstudie trat ein Makulaödem bei einem Patienten (0,3%) der Placebo-Gruppe und einem Patienten (0,3%) der 0,5mg-Fingolimod-Gruppe auf. Die meisten Fälle traten 3-4 Monate nach Behandlungsbeginn auf.
Schwere Nebenwirkungen und Todesfälle
In der Zulassungsstudie traten 3 Todesfälle auf. Zwei verstorbene Patienten waren in der Placebo-Gruppe und kamen durch einen Autounfall und eine Lungenembolie ums Leben, einer war in der 1,25mg-Fingolimod Gruppe und starb durch einen Suizid. In der Verlängerungsstudie kam es in einigen Fällen zu Herzrhythmusstörungen. Einen AV-Block (Verlinkung) 1. Grades hatten 17 Patienten (5%) der Fingolimod-Gruppe und 7 Patienten (2%) der Placebo-Gruppe. Ein AV-Block 2. Grades trat bei 7 Patienten (2%) der Fingolimod-Gruppe und 0 Patienten (0%) der Placebo-Gruppe auf. Alle Fälle traten während der 1. Gabe des Medikaments innerhalb der Beobachtungszeit auf und bildeten sich spontan zurück.
Krebserkrankungen
In der Zulassungsstudie FREEDOMS und in der TRANSFORMS-Studie (Velrinkung) traten keine Häufungen von Krebserkrankungen auf. In der Zulassungsstudie FREEDOMS bekamen 1 Patient der 1,25mg Fingolimod Gruppe, 4 Patienten der 0,5mg Fingolimod Gruppe und 3 Patienten der Placebo Gruppe ein Basalzellkarzinom.
Jedoch wurde in der Verlängerungsstudie FREEDOMS II unter Einnahme von Fingolimod eine Häufung von Basalzellkarzinomen (Verlinkung?) beobachtet. Dies ist eine bestimmte Art von Hautkrebs. Hier gab es in der Fingolimod-Gruppe 10 Fälle (2,8%) und in der Placebo-Gruppe 2 Fälle (0,6%). Dieser Unterschied war statistisch signifikant, d.h. dieser Studie nach traten Krebserkrankungen bei Fingolimod-Einnahme gehäuft auf.
Andere Krebsarten, die in der Zulassungsstudie auftraten, waren:
- Brustkrebs (1 Patient der 1,25mg Fingolimod-Gruppe, 3 Patienten der Placebo-Gruppe),
- Hautkrebse (ein Patient mit Morbus Bowen in der 1,25mg-Fingolimod-Gruppe, 2 Patienten mit malignen Melanomen, davon jeweils 1 Patient der 1,25mg-Fingolimod-Gruppe und 1 Patient der Placebo Gruppe)
- Gebärmutterhalskrebs (1 Patient der Placebo-Gruppe),
- Gebärmutterschleimhautkrebs (1 Patient der Placebo-Gruppe) und
- Prostatakrebs (1 Patient der Placebo-Gruppe).
Möglicherweise besteht unter Einnahme von Fingolimod ein geringfügig erhöhtes Risiko für Lymphdrüsenkrebs im Vergleich zur Normalbevölkerung. Die bisherigen Daten reichen nicht aus, um ein sicher erhöhtes Krebserkrankungsrisiko unter Fingolimod zu belegen. Es ist aber zu beachten, dass alle Medikamente, die das Immunsystem beeinflussen, das Krebsrisiko erhöhen können. Dies kann aber nur in Langzeitstudien geklärt werden.
Infektionen
In der Zulassungsstudie gab es keinen statistischen Unterschied des insgesamten Auftretens von Infektionen zwischen den Gruppen. Es kam in der Verlängerungsstudie FREEDOMS II aber signifikant häufiger zu schweren Infektionen, wobei es in der Fingolimod-Gruppe 11 (3%) schwere Infektionen gab und in der Placebo-Gruppe 4 (1%).
In der vergleichenden Zulassungsstudie TRANSFORMS (siehe weiter unten im Kapitel ...) traten zwei tödliche Gehirnentzündungen (Enzephalitiden – Verlinkung?) in der 1,25mg-Fingolimod-Gruppe auf. Eine davon hatte den Viruserreger Varizella zoster (Windpocken), und eine hatte den Viruserreger Herpes simplex. Einige weitere tödliche Herpes-Simplex-Infektionen wurden nach Markteinführung gemeldet.
Es ist zu beachten, dass alle Medikamente, die das Immunsystem beeinflussen, das Infektionsrisiko erhöhen können. Auch dies kann nur in Langzeitstudien geklärt werden.
Welche neuen Nebenwirkungen wurden nach Abschluss der Zulassungsstudien berichtet?
Progressive multifokale Leukenzephalopathie (PML)
Bei der Behandlung mit Fingolimod erkrankten bislang 24 Patienten auf über 267.000 behandlete Fälle an einer Viruserkrankung des Gehirns, der progressiven multifokalen Leukenzephalopathie (PML). Die PML tritt nur bei Menschen mit geschwächter Abwehr auf und kann zu schweren Behinderungen führen oder sogar tödlich sein. Bei 15 von diesen Fällen liegen Daten vor, wie sich die Erkrankung entwickelt hat. 3 von diesen 15 starben an den Folgen der PML. Möglicherweise steht das Risiko einer PML bei Fingolimod im Zusammenhang mit einer deutlich reduzierten Lymphozytenzahl.
Nach Übereinkunft von MS-Spezialisten und Behörden wurde der untere Grenzwert für Lymphozyten auf 500 pro Mikroliter (μl) festgelegt. Dieser Wert sollte nicht dauerhaft unterschritten werden. Zwischen 500 und 800/μl wird eine stärkere Überwachung empfohlen. Es ist dabei aber zu bedenken, dass die im Blut gemessene Anzahl der Lymphozyten nur einen groben Anhalt darüber geben kann, ob die Abwehrfunktionen des Immunsystems, beispielsweise gegen das PML-Virus, intakt sind.
Hämophagozytisches Syndrom
Ein Hämophagozytisches Syndrom ist eine seltene Erkrankung, die mit einer überschießenden Immunreaktion einhergeht, deren genaue Entstehung und Ablauf aber noch unerforscht ist. Es gab 2 Fälle von Patienten, die Fingolimod nahmen, die tödlich endeten.
Worauf muss bei der Therapie mit Fingolimod geachtet werden?
Worauf ist bei Therapiebeginn zu achten?
Weil Fingolimod das Immunsystem hemmt, sollten vor Therapiebeginn alle Standardimpfungen durchgeführt werden, die die STIKO (Ständige Impfkommission) für Menschen empfiehlt, deren Immunsystem teilweise blockiert werden soll.
Bei Patienten, die bereits eine Therapie erhalten haben, die das Immunsystem beeinflusst oder hemmt, müssen Sicherheitsabstände (siehe weiter unten) eingehalten werden. Diese richten sich nach der Wirkdauer der Medikamente. Eine Kurzzeitbehandlung mit Kortikosteroiden (Kortison), z.B. zur Schubtherapie, ist auch während der Behandlung möglich.
Unter welchen Umständen sollte Fingolimod nicht eingenommen werden?
Fingolimod sollte nicht eingenommen werden
- Bei schwerer Leberinsuffizienz
- Bei Herzrhythmusstörungen, Bradykardie (Herzschlagverlangsamung), vorherigen Gefäßereignissen (Herzinfarkt, Schlaganfall); bei bestimmten Herzmedikamenten muss die Einnahme mit dem Arzt besprochen werden
- Bei aktiven (schweren) Infektionen (besonders Tuberkulose und Hepatitis B und C)
- Bei immundefizienten Patienten
- Bei Patienten mit malignen ("bösartigen") Erkrankungen
- Bei Patienten mit Makulaödem (eine Erkrankung des Augenhintergrundes)
- Bei Schwangeren oder stillenden Patientinnen
- Bei Patienten mit einer Störung des Immunsystems, die „hämophagozytisches Syndrom“ genannt wird
- Mit Vorsicht und in Ausnahmesituationen bei mittelschwerer Leberinsuffizienz
- Mit Vorsicht und in Ausnahmesituationen bei schweren Atemwegserkrankungen, Lungenfibrose
Welche Sicherheitsabstände müssen eingehalten werden?
Bei Patienten, die bereits eine Therapie erhalten haben, die das Immunsystem beeinflusst oder hemmt, müssen Sicherheitsabstände eingehalten werden. Diese richten sich nach der Wirkdauer der Medikamente. Die Wartezeit beträgt nach der Behandlung mit...
- Teriflunomid mindestens 4 Wochen.
- Natalizumab und Daclizumab mindestens 6-8 Wochen.
- Azathioprin, Methotrexat und Mitoxantron mindestens 2-3 Monate.
- Cladribin mindestens 6 Monate.
- Alemtuzumab und Rituximab mindestens 6-12 Monate
- Bei der vorherigen Verwendung von Interferonen, Dimethylfumarat oder Glatirameracetat müssen, solange sich etwaige Blutbildveränderungen normalisiert haben, keine Sicherheitsabstände eingehalten werden.
Was muss während der Therapie kontrolliert werden?
Das Krankheitsbezogene Kompetenznetz Multiple Sklerose (KKNMS) empfiehlt:
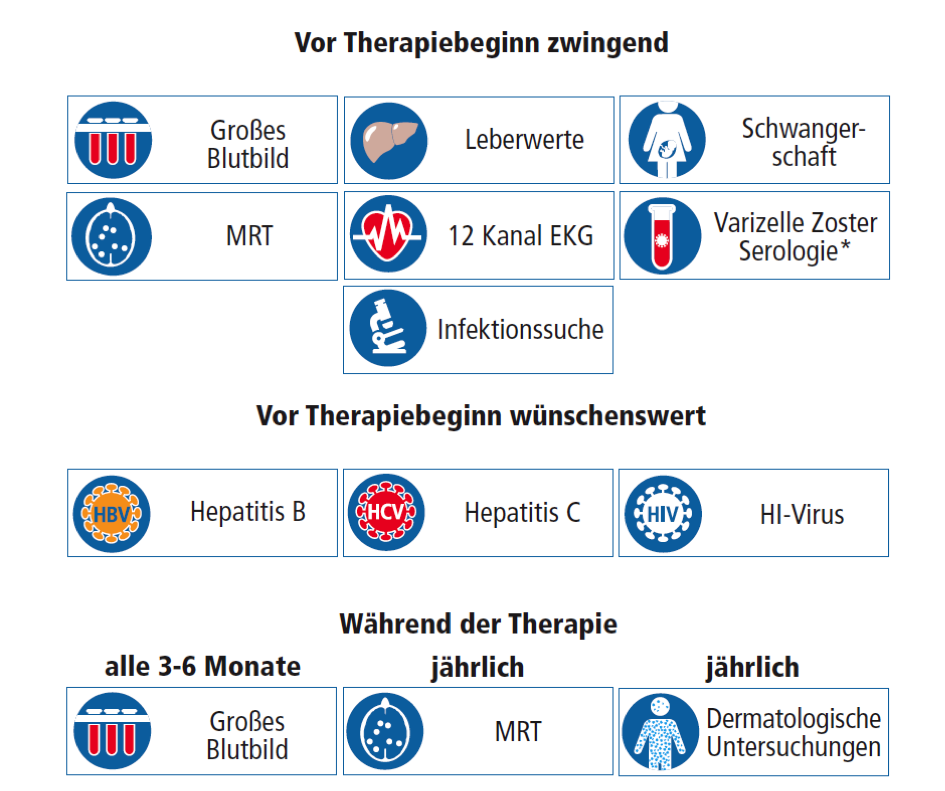
Eine Blutuntersuchung muss einmalig 4-6 Wochen nach Therapiebeginn gemacht werden, danach alle 3-6 Monate.
Bei Risikopatienten für eine Augenerkrankung (z.B. Diabetikern) muss ca. 4-6 Monate nach Therapiebeginn erneut eine Augenuntersuchung durchgeführt werden. Bei Lymphozytenwerten unter 200/μl sollte das Medikament ausgesetzt werden. Es kann erst wieder eingenommen werden, wenn die Lymphozyten mindestens 600/μl betragen.
Wenn die Leberwerte stark steigen (mindestens 5-fach über Normalwerte), müssen wöchentliche Kontrollen der Werte GOT, GPT GGT, AP und Bilirubin durchgeführt werden. Bei einem wiederholten Anstieg über das 5-fache der Normalwerte sollte Fingolimod abgesetzt werden.
Diese Empfehlungen sind als Vorsichtsmaßnahme zu werten. Gegenwärtig gibt es keinen Anhalt dafür, dass vorübergehende Erniedrigungen der Anzahl von Leukozyten und Lymphozyten ein Risiko darstellen.
Fingolimod - Häufig gestellte Fragen
Wirkt Fingolimod besser oder schlechter als andere MS-Medikamente?
Vergleich mit Beta-Interferonen:
In der Zulassungsstudie TRANSFORMS[21] von Cohen et al, die 2010 veröffentlicht wurde, wurden 1292 Patienten mit schubförmiger Multiple Sklerose über 1 Jahr entweder täglich mit oralem Fingolimod oder mit wöchentlichen Injektionen von Interferon Beta 1a behandelt. Dabei gab es eine Fingolimod-Gruppe, die 1,25mg bekam, und eine, die 0,5mg bekam. Teilnehmen konnten Patienten zwischen 18 und 55 Jahren mit einem EDSS Score zwischen 0 und 5,5, und die im letzten Jahr mindestens 1 Schub oder in den letzten 2 Jahren mindestens 2 Schübe hatten. Studienendpunkte waren die annualisierte (jährliche) Schubrate, neue Läsionen im MRT und eine Zunahme der Behinderung.
Die annualisierte Schubrate war in der 1,25mg-Fingolimod-Gruppe 0,2, in der 0,5mg-Fingolimod-Gruppe 0,16 und in der Placebo-Gruppe 0,33.
Unter Gilenya® nahm bei 94% gegenüber 92% unter Avonex® die Behinderung nicht zu. Ein Unterschied in der Zunahme der Behinderung zwischen den Gruppen wurde demnach nicht festgestellt.
Unter Gilenya® waren 83% der Patienten schubfrei, unter Avonex® 69%. Demzufolge spricht die TRANSFORMS-Studie für eine etwas größere Wirkung über ein Jahr Studiendauer gegenüber Avonex®. Ob dieser Effekt in längeren Studien anhält oder weniger wird, ist offen.
Es traten zwei tödliche Gehirnnfektionen in der 1,25mg-Fingolimod-Gruppe auf, eine Varizella zoster Enzephalitis und eine Herpes Enzephalitis. Im direkten Vergleich mit Interferon-Beta-Präparaten wies Fingolimod also eine geringere Schubrate und weniger MRT-Läsionen auf, die Zunahme der Behinderung war aber in beiden Gruppen gleich.
Vergleich mit Glatirameracetat (Copaxone®), Fumarat (Tecfidera®), Tecfidera (Aubagio®), Alemtuzumab (Lemtrada®):
Hierzu liegen keine Daten vor.
Vergleich mit Natalizumab (Tysabri®):
Aus dem internationalen MS-Base-Register konnten 792 Patienten gefunden werden, die bei Versagen einer Ersttherapie auf Tysabri oder Gilenya umgestellt wurden. Hier zeigten über 1 Jahr Beobachtung die Gilenya-Patienten fast dreimal so häufig eine Zunahme der Behinderung als die Tysabri-Patienten (Kalincik 2015 Ann Neurol). Bei allen Schwierigkeiten dieser Art von Vergleichen deuten die Zahlen doch an, dass Tysabri dem Gilenya überlegen ist.
Wie lange wird behandelt?
Es gibt bisher keine Empfehlung für die Dauer der Einnahme. In den Zulassungsstudien wurde Fingolimod über 2 Jahre untersucht. Andere Sicherheitssignale oder Nebenwirkungen als die oben beschriebenen wurden in 2-10 Jahren dauerhafter Fingolimod-Einnahme nicht beobachtet. Nutzen und Risiko der Einnahme müssen laufend überprüft werden. Ein Abschätzen des Nutzens ist oft frühestens nach einem Jahr möglich. Als Hinweise für eine Wirksamkeit werden allgemeine Schubfreiheit und das Fehlen neuer Herde im MRT angesehen. Deshalb empfiehlt das KKNMS eine Ausgangs-MRT und eine MRT nach 6, 12 und 24 Monaten, um Nutzen und auch mögliche Risiken abzuschätzen.
Schwangerschaft und Stillzeit
Fingolimod sollte in Schwangerschaft und Stillzeit nicht eingenommen werden.
Auf eine wirksame Verhütung sollte geachtet werden. Da Fingolimod über den Einnahmezeitraum hinaus wirken kann, sollte es 3 Monate vor einem geplanten Schwangerschaftsbeginn abgesetzt werden. Sollte eine ungeplante Schwangerschaft auftreten, muss diese nicht abgebrochen werden, aber Fingolimod sollte sofort abgesetzt werden.
In tierexperimentellen Studien wurde eine schädigende Wirkung von Fingolimod auf den Embryo beobachtet. Es gab ein gehäuftes Auftreten von Fehlgeburten und Herzfehlern. Es gibt nur begrenzte Erfahrungen zur Anwendung von Fingolimod bei schwangeren Frauen. 1813 dokumentierte Schwangerschaften von Frauen, die Fingolimod einnahmen, sind bis Februar 2018 registriert und dokumentiert worden. Von den 1813 Fällen waren 237 Fehlgeburten. Die Häufigkeit spontaner Fehlgeburten und die Häufigkeit von schweren Fehlbildungen liegt im Bereich der Normalbevölkerung. Möglicherweise geht Fingolimod in die Muttermilch über und sollte in der Stillzeit deshalb auch nicht eingenommen werden.
Impfungen
Die Wirksamkeit von Impfungen kann während der Einnahme und bis zu 2 Monate nach Absetzen von Fingolimod eingeschränkt sein. Sogenannte Lebendimpfstoffe, bei denen lebendige, aber unschädlich gemachte Erreger verwendet werden, müssen möglichst vermieden werden. Fingolimod-Patienten haben möglicherweise keine ausreichende Abwehr und könnten durch die eigentlich harmlosen Impferreger krank werden.
Infektionen
Beim Auftreten von Infektionen sollte ein Arzt aufgesucht werden, um die Infektion, den Erreger und eine Therapie zu bestimmen. Grundsätzlich muss Fingolimod beim Auftreten üblicher Infekte nicht abgesetzt werden. Bei gehäuften Infekten sollte Fingolimod aber abgesetzt werden, da es auf das Immunsystem wirkt.
Welche Alternativen bestehen zu Fingolimod?
Fingolimod ist nur eine von verschiedenen zugelassenen MS-Therapien. Eine Übersicht finden Sie auf der Hauptseite. Eine weitere Möglichkeit ist auch, (noch) keine Immuntherapie durchzuführen.
Ohne Therapie folgt die MS dem natürlichen Verlauf. Wie dieser aussieht, kann man aus den Daten der Placebo-Gruppe in der Zulassungsstudie FREEDOMS[54] abschätzen: Über 2 Jahre blieben in der Placebo-Gruppe 46 von 100 Patienten schubfrei und 81 von 100 (nach 6 Monaten) ohne Zunahme der Behinderung (siehe weiter oben im Kapitel „Wie wirksam ist Fingolimod bei schubförmiger MS?“).
Fingolimod - Alles auf einen Blick