Teriflunomid (Aubagio®)
Teriflunomid - Aubagio®
Teriflunomid (Aubagio®) ist zugelassen für Erwachsene mit schubförmiger MS. Es wird als Tablette in einer Dosierung von 14 mg 1x täglich eingenommen. Bei einem Teil der Patienten reduziert Teriflunomid die Schubrate und hält die Zunahme der Beeinträchtigung auf. An wichtigen Nebenwirkungen treten bei einem Teil der Patienten auf: Leberwerterhöhungen, Übelkeit und Durchfall, vorübergehender Haarausfall, Verminderung von weißen Blutkörperchen und eine leichte Blutdruckerhöhung. Zur Überwachung sollten im ersten halben Jahr der Therapie alle 14 Tage die Leberwerte bestimmt werden, danach alle 2 Monate. Das Blutbild muss während der gesamten Therapie alle 2 Monate kontrolliert werden. Ohne besondere Maßnahmen ist Teriflunomid noch 8 Monate bis 2 Jahre nach Therapieende im Blut nachweisbar, kann durch die Gabe von Colestyramin oder Aktivkohle jedoch in wenigen Tagen aus dem Körper entfernt werden.
Wirkungen & Nebenwirkungen im grafischen Überblick

Patienten ohne Zunahme der Behinderung


Was ist Teriflunomid?
Teriflunomid gehört zu einer Gruppe von Substanzen, die sowohl in der Natur (z. B. im Fliegenpilz) als auch als Grundlage entzündungshemmender Medikamente vorkommen. Es ist zudem ein biologisch aktives Stoffwechselprodukt von Leflunomid, einem Medikament, das in der Rheumatologie seit fast 20 Jahren in Tablettenform häufig zur Behandlung von entzündlichen Gelenkerkrankungen eingesetzt wird.
Wie wirkt Teriflunomid?
Teriflunomid gehört zu den sogenannten Immuntherapien der MS. „Sie wurden unter der Vorstellung entwickelt, dass es sich bei der MS vor allem um eine Erkrankung des Immunsystems handelt.
Generell zielen sie darauf ab, die Immunreaktionen teilweise zu unterdrücken. Das Immunmedikament hemmt ein Enzym, das im Zellstoffwechsel aktiver und schnell wachsender weißer Blutkörperchen (Leukozyten) notwendig ist. Besonders stark wachstumshemmend wirkt Teriflunomid auf zwei Untergruppen der weißen Blutkörperchen: die T- und B-Lymphozyten. Auch das Wandern weißer Blutzellen wird beeinflusst.
Das Medikament hat jedoch keinen Einfluss auf ruhende Zellen, sprich es zerstört weder Zellen noch beschädigt es deren Erbinformation. Andere Zellen als die Leukozyten werden in ihrem Stoffwechsel also wenig oder gar nicht von Teriflunomid beeinträchtigt.
Für wen ist Teriflunomid zugelassen?
Seit 2013 ist Teriflunomid von der Europäischen Arzneimittel-Agentur (EMA) zur Behandlung von erwachsenen Patienten mit schubförmiger Multipler Sklerose zugelassen.
Wie wird Teriflunomid eingenommen?
Teriflunomid wird einmal täglich als Tablette eingenommen, unabhängig von den Mahlzeiten und der Tageszeit. Zugelassen ist eine Dosis von 1 x 14 mg pro Tag.
Hier sehen Sie ein Foto der Medikamentenpackung und Tabletten von Aubagio®:
Bildquelle:https://www.deutsche-apotheker-zeitung.de/daz-az/2013/daz-39-2013/teriflunomid-neue-option-bei-multipler-sklerose
Wie wirksam ist Teriflunomid bei schubförmiger MS?
Im Glossar finden Sie unter "Allgemeines zu Wirkungen und Nebenwirkungen von MS-Medikamenten" eine allgemeine Einführung in die Thematik, welche Ihnen helfen kann, die nachfolgenden Informationen zur Wirkung von Teriflunomid besser zu verstehen.
Die folgenden Daten entstammen dem European Public Assessment Report (EPAR), also dem „Europäischen Öffentlichen Beurteilungsbericht“ der europäischen Zulassungsbehörde (EMA).
1. Wirkung auf die Schubfreiheit
Die Grafik am Kapitelanfang zeigt, wie viele Patienten nach zwei Jahren Therapie mit Teriflunomid bzw. Einnahme von Placebos noch schubfrei waren. Daraus kann man den absoluten Nutzen (absolute Risikoreduktion) und den relativen Nutzen (relative Risikoreduktion) berechnen.
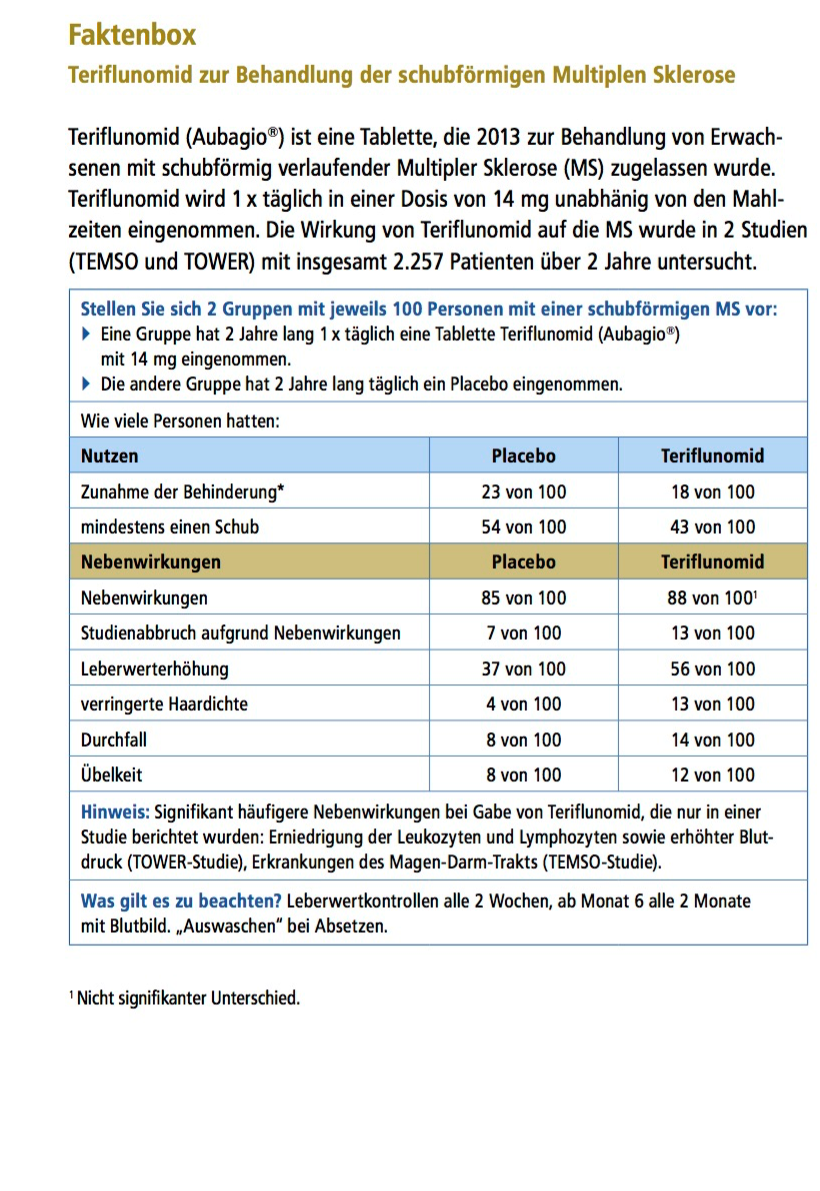
Hier wird die Anzahl der Patienten mit Schüben beschrieben. Um Studienergebnisse mit unterschiedlichen Teilnehmerzahlen besser vergleichen zu können, werden die Ergebnisse bezogen auf 100 Patienten dargestellt:
Der tatsächliche Therapieeffekt zeigt sich, wenn man die Anzahl von Patienten mit Schüben unter Teriflunomid (46) von denen mit Schüben unter Placebo (57) abzieht. Hier profitieren 57 – 46, also 11 von 100 Patienten von der Therapie.
- 11 von 100 Patienten haben einen Nutzen von der Therapie.
- 43 von 100 Patienten profitieren nicht von der Therapie, da sie trotz der Einnahme von Teriflunomid einen Schub hatten.
- 46 von 100 Patienten profitieren nicht, da sie auch ohne Teriflunomid schubfrei geblieben sind
2. Wirkung auf die Anzahl der Schübe pro Jahr
Die jährliche Schubrate zeigt, wie viele Schübe durchschnittlich pro Jahr pro Patient auftraten. Sie lag in der Placebo-Gruppe bei 0,53 Schüben gegenüber 0,35 in der Teriflunomid-Gruppe.
Etwas verständlicher ausgedrückt: Die Patienten in der Placebo-Gruppe haben im Durchschnitt ungefähr alle 2 Jahre einen Schub, die Patienten in der Teriflunomid-Gruppe nur etwa alle 3 Jahre.
3. Wirkung auf die Zunahme der Behinderung
Die Zunahme der Behinderung wurde in den oben beschriebenen Zulassungsstudien mit Hilfe des EDSS gemessen, einer Behinderungsskala von 0 bis 10 (wobei 0 keiner Behinderung entspricht). Die Grafik am Kapitelanfang zeigt, wie viele Patienten nach einer zweijährigen Therapie mit Teriflunomid bzw. zweijähriger Einnahme von Placebos keine Zunahme der Behinderung hatten. Dargestellt sind wieder der absolute Nutzen (absolute Risikoreduktion) und der relative Nutzen (relative Risikoreduktion).
Im Glossar finden Sie Angaben zum Nutzen von Medikamenten bei anderen Erkrankungen. So bekommen Sie einen Eindruck davon, wie groß die Therapieeffekte bei MS im Vergleich zu denen bei anderen Krankheiten sind.
Im Folgenden wird die Entwicklung der Behinderung in zwei Jahren beschrieben, jeweils bezogen auf 100 Patienten:
- 18 von 100 Patienten haben trotz der Teriflunomid-Therapie eine Zunahme der Behinderung.
- 77 von 100 Patienten profitieren nicht von der Therapie, sie haben unabhängig von der Therapie keine Zunahme der Behinderung.
- 7 von 100 Patienten haben durch die Einnahme von Teriflunomid keine Zunahme der Behinderung
Der tatsächliche Therapieeffekt zeigt sich, wenn man die Anzahl von Patienten mit einer Behinderungszunahme unter Teriflunomid (18) von denen mit Placebo (23) abzieht. Hier profitieren 25 - 18, also 7 von 100 Patienten von der Therapie.
4. Wirkung auf die MRT/das Kernspin in zwei Jahren
In der MRT treten Kontrastmittelanreicherungen und sogenannte T2-Herde auf, die als Ausdruck der Entzündung bei MS betrachtet werden. Dabei können Herde größer werden oder ganz neu auftreten.
In der TEMSO-Studie[52] wurde nicht die Anzahl der T2-Herde berichtet, sondern die Veränderung ihres Volumens. Das heißt, es wurde berechnet, wie viel Raum die T2-Herde einnehmen. Dies wird in Millilitern (ml) angegeben. Hier zeigte sich in der Placebo-Gruppe innerhalb von zwei Jahren eine Zunahme des T2-Volumens von 1,67 ml gegenüber einer Zunahme von 0,39 ml in der Teriflunomid-Gruppe.
Im Glossar finden Sie Daten zu dem Anteil der Patienten, bei denen es über 2 Jahre keine Anzeichen einer Krankheitsaktivität gab (NEDA - no evidence of disease activity).
Zulassungsstudien
Die Wirkung von Teriflunomid auf die Schubrate und die Zunahme der Behinderung wurde in zwei Zulassungsstudien (TEMSO[52] und TOWER[53]) geprüft. Die Ergebnisse wurden 2011 bzw. 2014 veröffentlicht.
- TEMSO (Randomized Trial of Oral Teriflunomide for Relapsing Multiple Sclerosis: Teriflunomide Multiple Sclerosis Oral Trial): 1.088 Patienten wurden zufällig in drei Gruppen eingeteilt und über zwei Jahre hinweg mit einem Placebo, 7 mg Teriflunomid oder 14 mg Teriflunomid behandelt.
- TOWER (Oral teriflunomide for patients with relapsing multiple sclerosis: a randomised, double-blind, placebo controlled phase 3 trial): 1.169 Patienten wurden behandelt, von denen ebenso eine Gruppe einen Placebo, eine 7 mg und eine 14 mg Teriflunomid erhielt.
Insgesamt wurden also 2.257 Patienten mit schubförmiger MS über einen Zeitraum von ca. zwei Jahren untersucht, die währenddessen entweder mit Placebo oder mit Teriflunomid behandelt wurden. In die Studien eingeschlossen wurden Patienten mit mindestens zwei Schüben in den letzten zwei Jahren oder mindestens einem Schub im Jahr vor Studienbeginn. Im Folgenden stellen wir die Ergebnisse einer zusammenfassenden Analyse (Metaanalyse) der europäischen Zulassungsbehörden beider Studien dar. Zu MRT-Untersuchen liegen nur Daten aus der TEMSO-Studie vor, da in TOWER keine MRT-Untersuchungen durchgeführt wurden. Die „gepoolte“ (zusammenfassende Analyse) der Daten zu Nebenwirkungen entstammt dem Europäischen Öffentlichen Beurteilungsbericht“ (EPAR) der europäischen Arzneimittel-Agentur (EMA).
Insgesamt zeigten beide Studien eine signifikant größere Wirksamkeit von Teriflunomid gegenüber einer Placebo-Gabe. Die niedrigere Dosis (7 mg) war weniger wirksam in Bezug auf die Zunahme der Beeinträchtigung. Wir stellen im Folgenden nur die Ergebnisse der höheren Dosierung (14 mg) vor, die auch in der EU zugelassen ist. Da die Resultate der beiden Studien sehr ähnlich ausfielen, entstammen die hier aufgeführten Daten aus der zusammenfassenden Analyse Analyse der EMA.
Es wurde noch eine weitere Studie durchgeführt (TENERE), bei der Teriflunomid mit Interferon-beta 1 a (Rebif® 44 ug) verglichen wurde. Aufgrund des Studiendesigns, z.B. der kurzen Dauer, ist die Aussagekraft dieser Studie jedoch beschränkt. Teriflunomid scheint in der Wirksamkeit auf die Schubfreiheit über ein Jahr vergleichbar mit Rebif zu sein.
Welche Nebenwirkungen hat Teriflunomid?
Bei wie vielen Patienten traten Nebenwirkungen auf?
Laut der gepoolten Analyse aus den Zulassungsstudien im EPAR (siehe oben im Kapitel "Welche Zulassungsstudien wurden durchgeführt?") hatten in der Placebo-Gruppe 90% Patienten Nebenwirkungen und in der Teriflunomid-Gruppe 92%. Der Unterschied war nicht statistisch signifikant.
Grundsätzlich ist wichtig zu wissen, dass Nebenwirkungen in Studien nicht nur bei den Patienten auftreten, die ein neues Medikament erhalten, sondern auch in der Studiengruppe mit einem bekannten Medikament oder Placebo.
Bei wie vielen Patienten führten die Nebenwirkungen zum Therapieabbruch?
Bei 13% in der Placebo-Gruppe und 16% in der Teriflunomid-Gruppe führten die Nebenwirkungen zum Abbruch der Behandlung. Dieser Unterschied war statistisch signifikant.
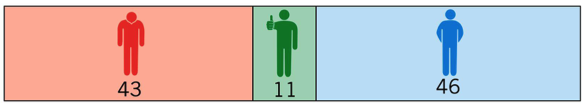
Häufige Nebenwirkungen
In einer Studie von Comi et al. wurden die Nebenwirkungsdaten aus mehreren Studien, darunter auch die aus TEMSO und TOWER, (gepoolt) zusammengefasst. Allerdings dauerten die Einzelstudien unterschiedlich lange, was dazu führte, dass die Nebenwirkungsdaten nicht gut vergleichbar waren und die zusammenfassende Analyse nicht geeignet war. Daher wurden die Nebenwirkungsdaten von den Autoren selbst gepoolt. In der Tabelle sind Nebenwirkungen aufgeführt, die bei mindestens 2% der Patienten auftraten. 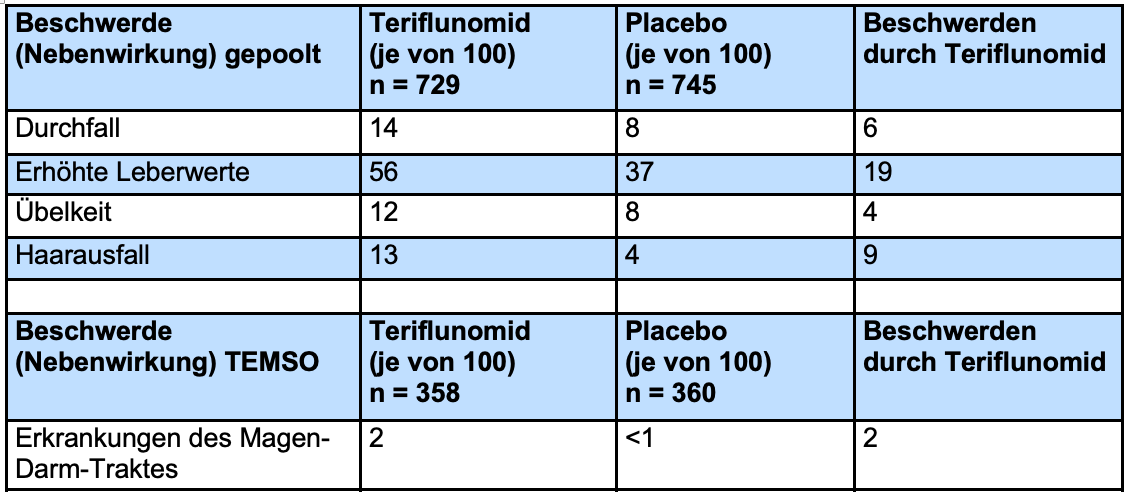
Eine verringerte Haardichte/ein Haarausfall trat am häufigsten innerhalb der ersten 6 Therapiemonate auf. In der Regel besserte sich die Haardichte im Verlauf der Therapie wieder.
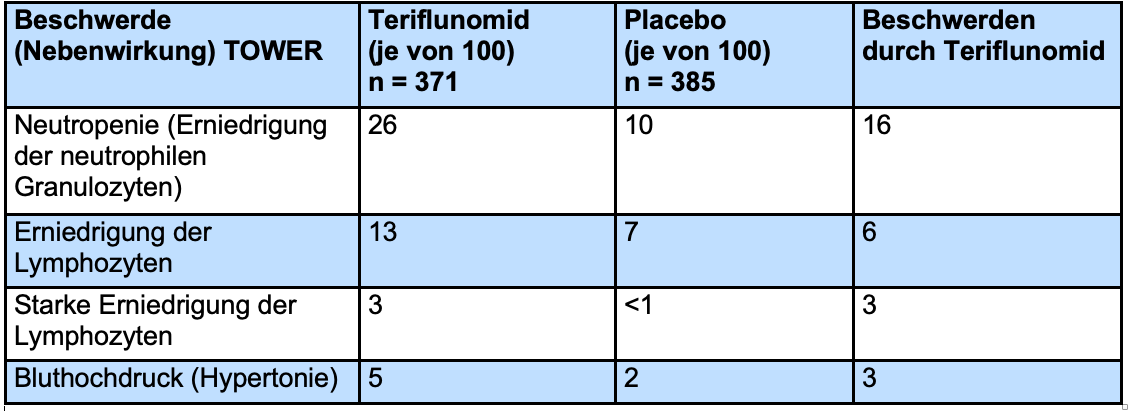
Darüber hinaus gab es einige Nebenwirkungen, die nur in einer der beiden Studien berichtet wurden. In der TOWER-Studie[53] traten signifikant häufiger Erniedrigungen der Leukozytenzahlen (Placebo-Gruppe 7%, Teriflunomid-Gruppe 17%) und Lymphozytenzahlen (Placebo-Gruppe 7%, Teriflunomid-Gruppe 16%) auf.
Zusätzlich zeigte sich eine Teriflunomid-bedingte Erhöhung des Blutdrucks bei 3 von 100 Patienten (5% Teriflunomid und 2% Placebo). In der TEMSO-Studie traten signifikant häufiger Erkrankungen des Magen-Darm-Trakts auf (Placebo-Gruppe <0,5% und Teriflunomid-Gruppe 2%).
Krebserkrankungen
In der Placebo-Gruppe lag die Krebsrate bei 1%. Es traten ein Brustkrebs, ein Schilddrüsenkrebs und ein Gebärmutterhalskrebs auf. Unter Teriflunomid wurde ein Fall eines Gebärmutterhalskrebses im Frühstadium dokumentiert. In der TOWER- Studie[53] trat in der Teriflunomid-Gruppe ein Schilddrüsenkrebs auf. Insgesamt traten Krebserkrankungen bei Teriflunomid-Einnahme also nicht gehäuft auf. Dennoch ist zu beachten, dass alle Medikamente, die das Immunsystem beeinflussen, das Krebsrisiko erhöhen können. Dies kann aber nur in Langzeitstudien geklärt werden.
Infektionen
Infekte traten bei der Therapie mit Teriflunomid nicht gehäuft auf. Dennoch ist zu beachten, dass alle Medikamente, die das Immunsystem beeinflussen, das Infektionsrisiko erhöhen können. Auch dies kann nur in Langzeitstudien geklärt werden.
Welche neuen Nebenwirkungen wurden nach Abschluss der Zulassungsstudien berichtet?
2017 kam es nach dreimonatiger Teriflunomid-Therapie und vorheriger Natalizumab-Therapie bei einem Patienten zum Verdacht auf eine Viruserkrankung des Gehirns, die progressive multifokale Leukenzephalopathie (PML). Die Diagnose wurde bisher nicht bestätigt. PML tritt nur bei Menschen mit geschwächter Abwehr auf und kann zu schweren Behinderungen führen oder sogar tödlich sein.
Worauf muss bei der Therapie mit Teriflunomid geachtet werden?
Unter welchen Umständen sollte Teriflunomid nicht eingenommen werden?
Teriflunomid sollte nicht eingenommen werden bei
- einer schweren Leberfunktionsstörung sowie einer akuten Leberentzündung (Hepatitis) oder einem schweren Eiweißmangel (Hypoproteinämie)
- einer Überempfindlichkeit gegenüber dem Wirkstoff
- Infektionen wie HIV, Hepatitis B oder C oder Tuberkulose
- einer Immunschwäche
- einer schweren dialysepflichtigen Einschränkung der Nierenfunktion
- einer schweren Erkrankung der Haut (Steve-Johnson-Syndrom, Erythema multiforme oder toxische epidermale Nekrolyse)
- Schwangerschaft oder Stillzeit
Worauf ist bei Therapiebeginn zu achten?
Weil Teriflunomid das Immunsystem hemmt, sollten vor Therapiebeginn alle Standardimpfungen durchgeführt werden, die die „Ständige Impfkommission“ (STIKO) für Menschen empfiehlt, deren Immunsystem teilweise blockiert werden soll.
Welche Sicherheitsabstände müssen eingehalten werden?
Bei Patienten, die bereits eine Therapie erhalten haben, die das Immunsystem beeinflusst oder hemmt, müssen vor einer Umstellung auf Teriflunomid bestimmte Sicherheitsabstände eingehalten werden. Diese richten sich nach der Wirkdauer der Medikamente. Die Wartezeit beträgt nach der Behandlung mit...
- Fingolimod mindestens 4 Wochen.
- Natalizumab und Daclizumab mindestens 6 – 8 Wochen.
- Azathioprin, Ciclosporin A, Cyclophosphamid, Methotrexat und Mitoxantron mindestens 3 Monate.
- Cladribin mindestens 6 Monate.
- Alemtuzumab, Ocrelizumab und Rituximab mindestens 6 – 12 Monate.
Bei der vorherigen Verwendung von Interferonen, Glatirameracetat oder Dimethylfumarat müssen, solange sich etwaige Blutbildveränderungen normalisiert haben, keine Sicherheitsabstände eingehalten werden. Eine Kurzzeitbehandlung mit Kortikosteroiden (Kortison), zum Beispiel zur Schubtherapie, ist auch während der Behandlung mit Teriflunomid möglich.
Was muss bei der Therapie kontrolliert werden?
Das Krankheitsbezogene Kompetenznetz Multiple Sklerose (KKNMS) empfiehlt:
- Patienten, deren Lymphozytenzahlen während der Teriflunomid-Behandlung unter einen Grenzwert von 200 Zellen/μl sinken, müssen die Therapie beenden.
- In den ersten 6 Monaten der Teriflunomid-Einnahme müssen die Leberwerte alle 2 Wochen bestimmt werden. Waren diese unauffällig, können die Kontrollen ab dem 6. Monat alle 2 Monate erfolgen. Für den gesamten Zeitraum der Therapie gilt, dass bei einem leichten Anstieg der Leberenzymwerte bis auf maximal das 2-fache des oberen Normwertes eine nächste Kontrolle in 2 Wochen erfolgen muss, bei einem Anstieg über das 2-fache des oberen Normwertes müssen die Werte mindestens 1x wöchentlich kontrolliert werden. Liegt der Wert für die Leberenzyme wiederholt über dem 3-fachen des oberen Normwertes, muss Teriflunomid abgesetzt werden.
Kontrolle des Blutdrucks
Während der Einnahme von Teriflunomid sollte mindestens halbjährlich der Blutdruck kontrolliert werden, unabhängig davon, ob ein Bluthochdruck (Fachbegriff: eine Hypertonie) bekannt und/oder sogar behandelt ist. Abhängig von den Messwerten wird der Beginn oder eine Anpassung der Behandlung des Bluthochdrucks empfohlen.
Wechselwirkungen mit anderen Medikamenten
Teriflunomid wird über Enzyme verstoffwechselt, die auch für den Abbau anderer Medikamente und Hormone von Bedeutung sind. Dadurch besteht die Möglichkeit einer Wechselwirkung mit der Gefahr einer Konzentrationsänderung bestimmter Medikamente.
Teriflunomid - Häufig gestellte Fragen
Wie lange wird behandelt?
Teriflunomid wird als Dauertherapie eingesetzt. Nutzen und Risiko der Einnahme müssen laufend überprüft werden. Ein Abschätzen des Nutzens ist oft frühestens nach einem Jahr möglich. Als Hinweise für eine Wirksamkeit werden allgemeine Schubfreiheit und das Fehlen neuer Herde in der MRT angesehen. Deshalb empfiehlt das Krankheitsbezogene Kompetenznetz Multiple Sklerose (KKNMS) eine Ausgangs-MRT und anschließend jährlich eine MRT, um Nutzen und auch mögliche Risiken abzuschätzen.
Schwangerschaft und Stillzeit
Teriflunomid darf in Schwangerschaft und Stillzeit nicht eingenommen werden, da in Tierversuchen eine schädigende Wirkung auf den Embryo gezeigt wurde.
Bis 2014 sind während der Einnahme von Teriflunomid insgesamt 89 Schwangerschaften aus dem klinischen Studienprogramm und dessen Verlängerungsstudien bekannt geworden. Davon traten 70 Schwangerschaften bei Frauen auf, die Teriflunomid selbst eingenommen hatten und 19 bei Partnerinnen von männlichen Teriflunomid-Patienten. 42 Kinder kamen gesund zur Welt (26 von Patientinnen, die Teriflunomid eingenommen hatten, 16 von Partnerinnen von Männern, die Teriflunomid einnehmen). In 31 Fällen entschieden sich die Frauen für einen Schwangerschaftsabbruch, allerdings in keinem Fall aufgrund des Nachweises einer Fehlbildung oder eines Defekts. In 14 Fällen kam es zu einem spontanen Abort. In zwei Fällen war der Ausgang der Schwangerschaft unbekannt, ein Fall davon aufgrund von noch andauernder Schwangerschaft.
Bei Kinderwunsch sollte das Arzneimittel abgesetzt werden. Außerdem ist es ratsam, den Wirkstoff mittels Colestyramin oder Aktivkohle rasch auszuwaschen. Es muss eine wirksame Empfängnisverhütung erfolgen, auch nach Absetzen des Medikaments, bis die Blutkonzentration von Teriflunomid unter einem gewissen Grenzwert liegt. Erst ab einer Konzentration unter 0,02 mg/l kann die Patientin versuchen, schwanger zu werden. Im Fall einer unerwarteten Schwangerschaft unter Teriflunomid-Einnahme wird eine schnelle Auswaschung des Immunmedikaments (siehe unten) nachdrücklich empfohlen. Es besteht kein zwingender Anlass für einen Schwangerschaftsabbruch.
Da bekannt ist, dass Teriflunomid in die Muttermilch übergeht, sollte es in der Stillzeit nicht eingenommen werden.
In den Studien traten 11 Schwangerschaften auf. Dabei kam es zu vier Fehlgeburten (eine unter Placebo und drei unter Teriflunomid) sowie sechs Abtreibungen (alle unter Teriflunomid). Ein Kind wurde unter der Gabe von 14 mg gezeugt und kam gesund zur Welt, nachdem die Therapie nach 31 Tagen abgebrochen wurde.
Auswaschung von Teriflunomid
Grundsätzlich bestehen zwei Möglichkeiten, Teriflunomid schnell aus dem Körper zu entfernen:
- Einnahme von 8 g Colestyramin 3 x täglich (alle 8 Stunden) für insgesamt 11 Tage. Aus Verträglichkeitsgründen kann die Colestyramindosis auf 4 g, 3x täglich verringert werden.
- Einnahme von 50 g Aktivkohle 2 x täglich (alle 12 Stunden) für insgesamt 11 Tage.
Dabei muss das Auswaschen nicht zwingend an aufeinanderfolgenden Tagen durchgeführt werden. Ggf. kann zur Überprüfung der erfolgreichen Entfernung eine Bestimmung der Konzentration von Teriflunomid im Blut erfolgen.
Impfungen
Bisher sind keine negativen Effekte auf Impferfolge bekannt. Einige Daten sprechen dafür, dass Standardimpfungen unter Teriflunomid wirksam bleiben (zum Beispiel die Grippeimpfung). Sogenannte Lebendimpfstoffe, bei denen lebendige, aber unschädlich gemachte Erreger verwendet werden, müssen möglichst vermieden werden: Teriflunomid-Patienten haben möglicherweise keine ausreichende Abwehr und könnten durch die eigentlich harmlosen Impferreger krank werden.
Infektionen
Grundsätzlich muss Teriflunomid beim Auftreten üblicher Infekte nicht abgesetzt werden. Bei schweren oder gehäuften Infekten müssen im Einzelfall jedoch ein Absetzen und ggf. eine rasche Auswaschung erwogen werden.
Welche Alternativen bestehen zu Teriflunomid?
Teriflunomid ist nur eine von verschiedenen zugelassenen MS-Therapien. Eine Übersicht finden Sie auf der Hauptseite. Eine weitere Möglichkeit ist auch, (noch) keine Immuntherapie durchzuführen. Weitere Informationen dazu finden Sie in Kapitel 6 "Was erwartet mich bei Multipler Sklerose ohne Therapie?". Ohne Therapie folgt die MS dem natürlichen Verlauf. Wie dieser aussieht, kann man aus den Daten der Placebo-Gruppe in der Zulassungsstudie (siehe weiter oben im Kapitel) abschätzen: Über zwei Jahre hinweg blieben in der Placebo-Gruppe 46 von 100 Patienten schubfrei und 73 von 100 ohne Zunahme der Beeinträchtigung.
Teriflunomid - Alles auf einen Blick